在再生医学、器官芯片和药物筛选等交叉领域中,纷繁复杂的场景对血管网络构建技术提出了越来越高的“适应性(adaptability)”要求:不仅要精准还原目标结构与尺寸,还需兼容多种材料体系以实现功能适配,以此来满足不同的应用目的。目前,牺牲模板法(sacrificial templating)因其工艺简便、适配性广,成为构建通道网络的常用策略。该方法通过预先打印可移除的牺牲材料(sacrificial materials),将其嵌入至基材中,待基材固化后溶解模板,从而形成通道结构。然而,现有牺牲材料在实际应用中普遍存在三类问题:1)打印成型性有待改善,难以构建多级分支结构(如明胶);2)溶解时易发生溶蚀变形,导致通道保真度下降,影响尺寸还原(如PVA、Pluronic F-127);3)材料兼容性不佳,只能选择单一的亲水或疏水性基材,或依赖特定的打印体系(如嵌入式打印)。
澳门大学王春明教授团队提出“通过非溶剂(nonsolvent)控制氢键取向来稳定牺牲材料界面”的策略解决。牺牲材料在嵌入过程中界面不稳定是限制适应性的底层原因,界面不稳定将导致基材中的溶剂在固化前快速渗入模板内部,使其在被移除前出现不可控的溶胀(亲水性基材)或脱水变形(疏水性基材),最终破坏预设的通道结构。非溶剂是指可与水互溶但无法溶解牺牲材料的有机试剂。此前,团队已在相关研究中提出“非溶剂淬火(nonsolvent quenching, NSQ)”打印方法(Adv Sci 2022, 2203236),通过诱导材料表面快速硬化,在界面形成致密保护层,有效提升结构保真度。在本研究中,团队进一步推测该过程可驱动材料表面氢键由“指向外部溶剂”转变为“材料内部自连”,进而建立起抵御外部侵蚀的稳定屏障,从而抑制牺牲模板在嵌入基材后的膨胀与变形,基于此提出氢键重定向策略(Hydrogen Bond Re-Orientation, HyBRO),通过将氢键从“向外”转为“向内”,实现对界面的有效保护(图1)。
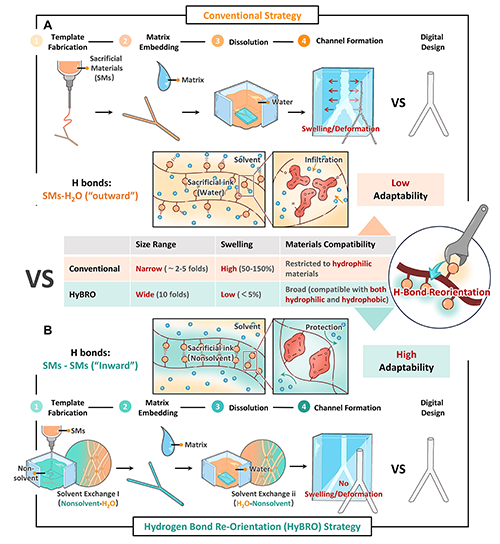
图1. 传统策略 vs HyBRO:通过氢键定向调控,实现高适应性的血管网络构建工艺
为验证HyBRO策略的分子机制,课题组以模式分子葡甘聚糖(GM)为模型,系统研究了非溶剂DMF在淬火过程中的氢键重定向效应。实验发现,在加入氢键干扰剂尿素后,相分离显著延迟,表明氢键作用是驱动淬火的关键。SAXS结果显示,NSQ处理将促使GM形成更致密、稳定的聚集体;ATR-FTIR分析进一步确认,淬火显著提升了GM链间氢键比例,同时抑制了GM与外部溶剂(水)之间的氢键形成,验证了氢键从“对外”向“内聚”的定向转变。
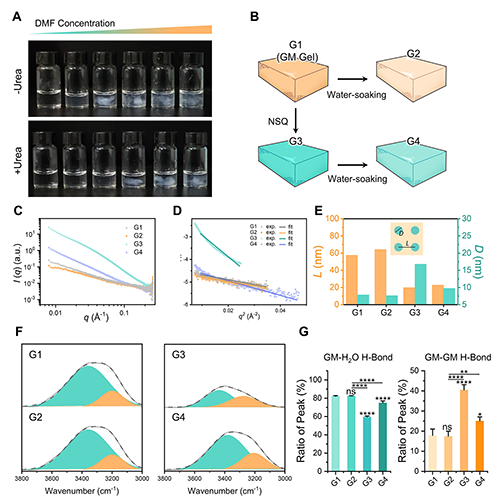
图2. NSQ实现GM氢键重定向
在明确这一机制后,团队进一步验证了HyBRO策略的实际效果。实验表明,未经处理的块状凝胶在水中易发生剧烈溶胀,溶胀变化超过320%;而经HyBRO处理后,溶胀率控制在约131%,结构稳定性显著提升。更重要的是,HyBRO模板生成的通道尺寸与设计值高度一致,误差控制在±10%以内,有效保障了通道结构的保真度与一致性。借助这一策略,团队在明胶和海藻酸钠体系中成功构建出三次分叉的层级血管网络,通道直径覆盖40~400 μm,精准实现从微血管到小动脉的十倍尺度跨越,充分展示了HyBRO在通道精度、尺寸可控性和复杂结构再现方面的综合优势。
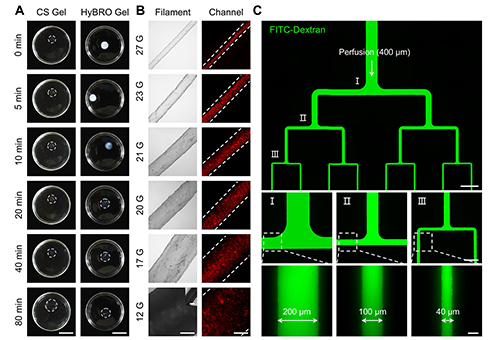
图3. HyBRO显著抑制溶胀,实现高保真度通道构建
鉴于传统方法在亲疏水材料间的选择受限,课题组进一步将HyBRO策略扩展应用于多种代表性材料,以验证其广谱兼容能力。结果显示,HyBRO可在海藻酸钠、明胶、琼脂糖和GelMA等常见亲水性基材中稳定构建通道结构;同时,在乙酰化葡甘聚糖、聚己内酯和聚乳酸-羟基乙酸共聚物等疏水性基材中同样表现出良好成型能力。此外,HyBRO不仅适用于GM类多糖材料,对于传统的PVA模板也能显著提升其结构保真度,进一步印证了该策略在不同材料平台下的适用性。

图4. HyBRO可与多种亲/疏水基材兼容
HyBRO策略不仅具有优越的适应性,还能支持内皮细胞生长和功能表达。实验表明,内皮细胞在通道内可逐步建立稳定的胞间连接,显著抑制物质的渗透,展现出典型的血管屏障功能。更重要的是,该通道系统能够模拟生理剪切应力,诱导内皮细胞通过TRPV4感知流体刺激,激活钙信号通路并促进一氧化氮释放,呈现出与真实血管相似的力学应答与生理调控特性。这一系列结果表明,HyBRO不仅可实现结构精细、尺寸可控的血管网络构建,更具备重建具功能活性血管系统的潜力。
本研究提出的HyBRO策略通过“氢键重定向”机制,有效解决了传统牺牲模板法在“适应性”上的瓶颈。该策略不仅可精准构建高保真度(>90%)、多尺度(10倍跨越)通道网络,还广泛兼容多类亲水与疏水材料,并支持内皮细胞的功能性生长及剪切力响应,实现了结构与生理功能的协同重建,为再生医学等领域的血管化构建提供了一个通用兼容的新技术平台。相关成果以 “A Highly Adaptable Hydrogen Bond Re-Orientation (HyBRO) Strategy for Multiscale Vasculature Fabrication” 为题发表于《Advanced Materials》。论文第一作者是澳门大学博士生(现博士后)廖祯诚博士,其也是前期设计非溶剂淬火打印技术的论文的第一作者。研究获得澳门科技发展基金、国家自然科学基金、江苏省自然科学基金及澳门大学科研基金的联合资助。欢迎访问课题组网站(https://sklqrcm.um.edu.mo/chun-ming-wang/)开展交流合作。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202417734?af=R
