胶质母细胞瘤(GBM)术后复发几乎不可避免,一个关键原因是残留区域富集的胶质瘤干细胞(GSCs)仍能在术腔周围组织找到适合其存活与自我更新的生态位。目前的治疗手段包括手术、放疗、化疗和免疫治疗都很难有效清除GSCs。近日,福州大学林立森教授团队与新加坡国立大学陈小元教授团队合作,报道了一种可在肿瘤切除后直接植入术腔的生物杂化D-手性水凝胶,试图在术腔边缘塑造不利于干细胞生存的人工三维基质。该水凝胶一方面封装GSCs膜包被的纳米颗粒(GSNP),它们作为受体谱完整的诱饵,广谱中和促干性与趋化因子,并促进GSCs向水凝胶内浸润;另一方面利用D-手性几何微结构调控整合素相关力学转导,进一步削弱干性维持。在小鼠的三种原位颅内GBM术后模型中,这种多管齐下的抑制策略显著增强了临床上标准治疗策略的效果,有效抑制GBM术后复发。
2025年12月26日,相关工作以A biohybrid chiral hydrogel enhances preclinical postoperative glioblastoma therapy by multi-pronged inhibition of tumour stemness为题发表在Nature Nanotechnology上。

图|生物杂化手性水凝胶用于克服GSCs治疗抵抗性、抑制术后肿瘤复发示意图
1. 生化因子补偿 + 物理微环境共同驱动复发
GBM术后空腔周围的免疫细胞与基质细胞等可分泌多种促干性因子,因此阻断单一通路往往会被旁路补偿。此外,细胞外基质并非被动支架,其精细结构包括超分子尺度的手性、几何特征能够通过整合素介导的机械转导调控干性命运。由此,作者将术后复发看作由生物化学与生物物理诱因共同驱动的问题,局部治疗材料需要同时调整这两类通路。
2. 把水凝胶从药物载体升级为三维的重塑-治疗一体化基质
GSNP模块利用GSCs自身细胞膜保留的受体谱作为诱饵,广谱地吸附、中和多类促干性因子,一定程度上解决多通路代偿问题。并且它通过与趋化因子的相互作用,在水凝胶内形成有利于GSCs浸润的信号环境,从而实现把目标细胞引进水凝胶的效果。D-手性水凝胶模块通过氨基酸对映体与金簇构建的手性几何微结构,抑制浸润细胞的膜整合素相关的力学转导,进而促进GSCs干性表型下降。与此同时,水凝胶缓慢释放的金簇会被敏化的肿瘤细胞摄取,可以作为放疗增敏剂促进肿瘤细胞的免疫原性死亡,从而激活系统免疫反应。

图|封装GSNP的手性水凝胶的表征
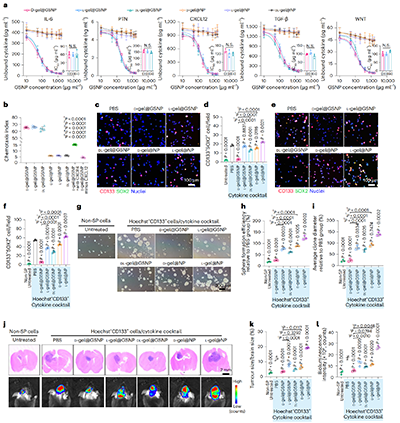
图|D-gel@GSNP在体外对肿瘤干性的抑制作用
3. 机制与疗效
GSNP表面的GSCs膜保留了受体,可以结合多种细胞因子,在不依赖抑制剂组合的情况下,实现对多重GSCs信号网络的并行拦截。转录组与通路富集分析进一步证实D-gel@GSNP 显著下调了JAK-STAT、TGF-β、NF-κB、PI3K-AKT、Chemokine signaling等关键干性维持通路。GSNP的细胞膜还保留了能结合 CXCL12的糖胺聚糖结合域(GAG),形成局部固定化的趋化梯度,同时释放部分CXCL12形成可溶性梯度。这种固定加可溶的双重梯度结构,选择性促进 CXCR4+ GSCs向水凝胶内迁移与富集。在GSCs被引入水凝胶后,文章通过系统对照D-、L-与DL-手性水凝胶,证明D-手性基质对纤连蛋白的吸附亲和力显著降低,由此削弱细胞膜上的整合素聚集与黏附斑形成。因此,下游机械敏感信号轴被抑制,最终导致SOX2、CD133、OCT4等干性相关基因的转录程序被压制。值得强调的是,文章证明仅有D-手性或仅有因子中和均不足以显著削弱干性,二者协同才产生决定性效应。总的来说,D-手性的生物杂化凝胶通过同时重塑GSCs的信号输入、空间位置与力学感知,将最难杀的术后残留细胞转化为对放疗和免疫高度敏感的靶标。

图|D-gel@GSNP介导的干性降低机制、放疗增敏及体外免疫激活作用
4. 小鼠模型原位疗法
该研究以术腔内原位植入水凝胶为核心干预手段,直接嵌入“手术切除加放疗/化疗”的临床标准治疗流程。结果显示,该水凝胶能够在复发高发的切除腔边缘形成稳定的三维局部治疗基质,通过GSNP广谱中和促干性与趋化信号并引导术腔周围残留GSCs向凝胶内浸润,再由D-手性微结构抑制整合素相关力学转导,从而在放疗前削弱肿瘤的干性基础。与此同时,凝胶内金纳米簇的局部释放增强了肿瘤细胞对放疗的敏感性,整体上将术后标准治疗从被动清除残留升级为局部微环境预处理加治疗增强的联合策略。

图|D-gel@GSNP-aPD1与胶质母细胞瘤(GBM)标准治疗在CT2A-GBM小鼠模型中对复发抑制和免疫激活的协同作用
总结:
这种局部水凝胶治疗为术后肿瘤管理提供了高度可拓展的平台:其三维结构、力学性质与功能组分均可按需调控,具备与多种系统治疗进行时序化、个体化组合的优势,亦有望推广至其他干细胞驱动、微环境依赖型肿瘤。与此同时,向临床转化仍需系统评估不同术腔尺度下的材料铺展与降解行为、长期安全性以及膜仿生组分的规模化与合规路径;通过发展合成仿生替代材料并在更接近临床的模型中验证,该策略有望进一步提升其转化可行性与应用广度。
链接地址:https://www.nature.com/articles/s41565-025-02064-2
- 上海交通大学冯传良教授课题组在仿生手性水凝胶领域取得重要研究进展 2019-06-12
- 上海交通大学冯传良教授课题组与北京大学口腔医院邓旭亮教授、卫彦副教授团队在手性水凝胶的研究方面取得新进展 2019-04-25
- 上海交大冯传良教授课题组在仿生手性水凝胶对细胞选择性黏附领域的研究取得的重要进展 2018-05-02
- 东华大学沈明武/史向阳教授团队 AM:细胞膜仿生的聚合物纳米颗粒通过放大内质网应激和诱导线粒体功能障碍的化疗增强肿瘤免疫治疗 2022-09-22
- 烟台大学陈大全教授团队:结合中医药引经理论,构建基于桔梗多糖的巨噬细胞膜仿生纳米载体用于靶向肺炎以及平息细胞因子风暴 2022-02-11
- 东华大学史向阳教授课题组《ACS Nano》:巨噬细胞膜仿生的多功能纳米凝胶用于MR成像引导的原位脑胶质瘤联合治疗 2021-12-06
