9月17日,Cell(《细胞》)杂志在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所朱学良研究组和美国华盛顿卡内基研究所郑诣先研究组的合作论文Phase Transitions of Spindle-Associated Protein Regulate Spindle Apparatus Assembly。该研究发现,有丝分裂调节蛋白BuGZ能在生理条件下发生相变,导致大量的BuGZ分子聚合形成特殊结构。而且,这种相变对细胞有丝分裂纺锤体的组装有重要的促进作用。“相变”作为物质的一种特性(如水、冰和水蒸气之间的转换)在物理世界早已广为人知,但细胞中蛋白质的相变及其生物学功能的发现还是凤毛麟角。
有丝分裂是细胞增殖时染色体均等分离的过程,对生命的遗传稳定性至关重要,而纺锤体(spindle)是负责染色体分离的细胞器,其中由微管蛋白聚合形成的细胞骨架——微管负责结合、牵拉染色体。郑诣先和朱学良的实验室一直通过合作研究致力于阐释纺锤体微管之外的基质成分(spindle matrix)的结构、性质和功能,最近曾合作发现BuGZ对有丝分裂的高效性和精确性有重要贡献。在此项研究中,他们共同指导的博士后姜昊及其科研伙伴发现BuGZ富含进化上保守的低复杂性区域(low complexity domain)。有趣的是,该区域可通过分子间的疏水相互作用使BuGZ形成大小不一的液滴状结构,并从水溶液中分离出来。液滴的形成是可逆的,需要适当的温度和浓度,符合物质的相变(phase transition)特征。而且,BuGZ形成的液滴可以富集微管蛋白、促进微管聚合,并使微管成束。BuGZ还能在微管上发生相变,且微管的存在能大大降低BuGZ发生相变所需的浓度。更重要的是,BuGZ的相变促进了纺锤体基质的组装和纺锤体的形成。这些发现为有丝分裂的调节机理提供了新的概念和知识,并为该领域的研究开启了一扇新大门。
该项研究得到国家自然科学基金委、科技部、中科院等机构的经费支持。
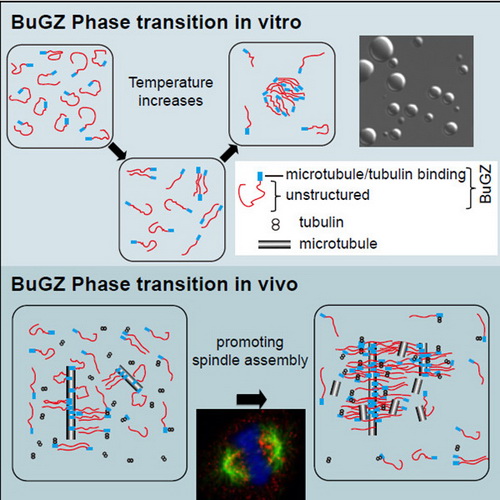
BuGZ在体外(in vitro)和体内(in vivo,纺锤体形成阶段)的相变及其功能示意图。黑白显微图片为BuGZ形成的液滴。彩色图展示有丝分裂细胞中的BuGZ(红色)、纺锤体微管(绿色)和染色体(蓝色)。
