与传统的缝合线或缝合钉相比,使用粘合剂的方法能够更有效地闭合创口,阻止血液和气体的泄露。然而,现有的医用粘合剂不能完全满足术后要求,例如氰基丙烯酸酯类粘合剂(与502胶水类似)虽然粘接强度高,但是具有一定的细胞毒性且容易形成硬相区域;纤维蛋白类粘合剂虽具有良好的生物相容性,但与组织粘附性弱,不适合用来封堵诸如心血管及肺部等需要承受一定压力的区域。另一方面,粘合剂在植入人体后,应随伤口的愈合逐渐降解,避免二次手术。尽管需求明确,但目前仍缺乏同时具有强韧粘接和生物可降解的组织粘接材料。
哈佛大学锁志刚教授课题组与David Mooney教授提出适用于生物组织的湿表面粘接(Science 2017, 357 (6349), 378-381),实现了水凝胶与生物组织的强韧粘接。该方法以具有良好生物相容性的壳聚糖作为桥接网络,成功将水凝胶与不同组织形成有效粘接。粘接能(>1000J/m2)远高于目前商用生物粘合剂(~10 J/m2),甚至能承受远高于血压的爆破压测试。
基于此上研究,他们进一步设计了强韧可降解的水凝胶作为敷料,使用上述粘接技术,实现了同时具有高强度和可降解性的水凝胶-生物组织粘接。
1.降解原理
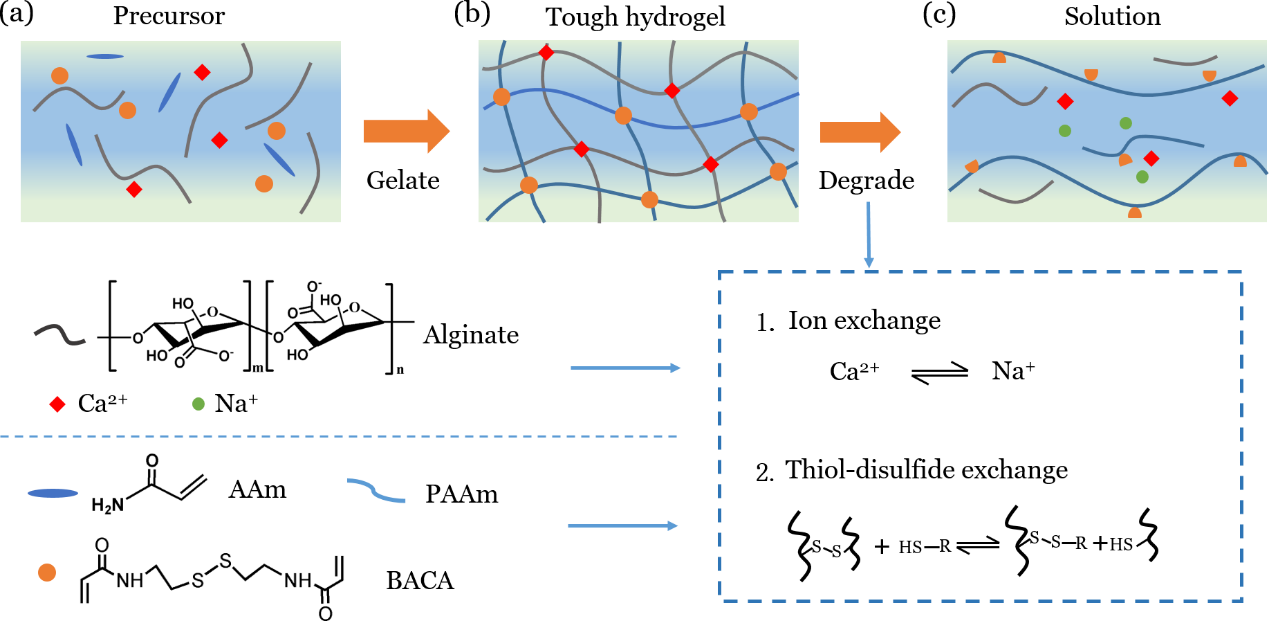
实现强韧粘接,需要具有良好的粘接层和强韧的敷料材料。研究人员使用强韧的聚丙烯酰胺-海藻酸钠双网络水凝胶作为敷料材料。如图所示,使用钙离子Ca2+作为海藻酸钠交联点,在体内,由于体液中盐分与Ca2+发生离子交换进而使得海藻酸钠网络降解;使用二硫键作为聚丙烯酰胺的交联点,由于二硫键-巯基交换作用使得聚丙烯酰胺网络降解,人体本身的氨基酸具有巯基(如半胱氨酸)可作为降解材料。
2. 水凝胶本身的降解
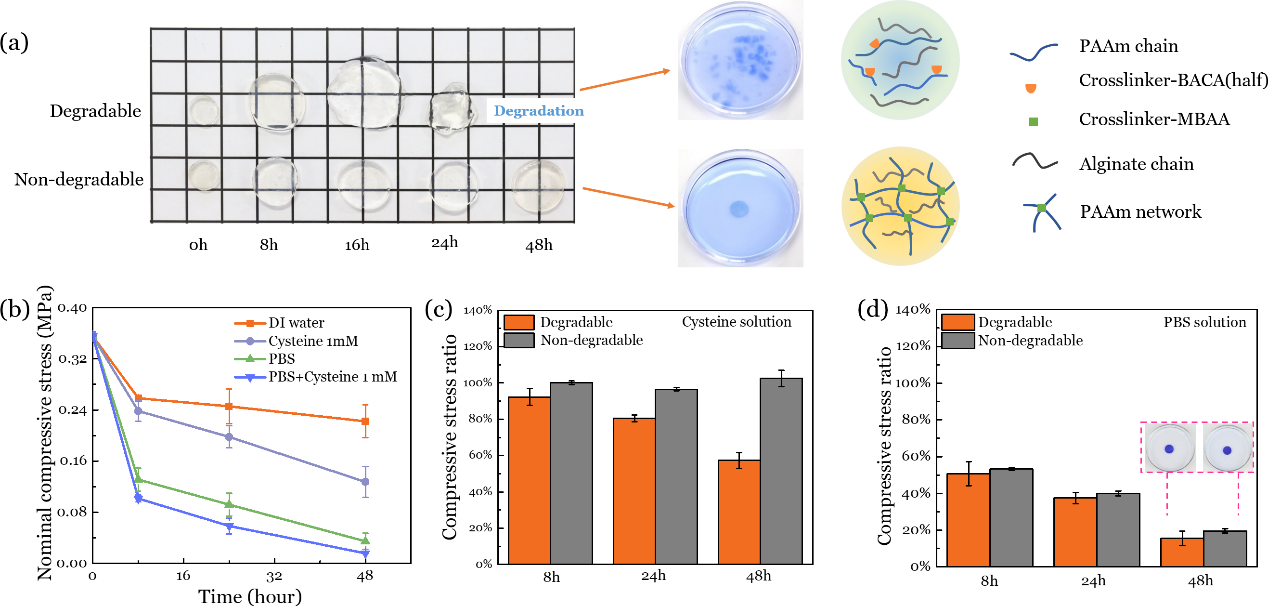
研究人员比较了传统的不可降解韧性水凝胶(交联剂为N-N’亚甲基双丙烯酰胺(MBAA))和可降解韧性水凝胶(交联剂为具有二硫键-巯基交换的N-N’双(丙烯酰)胱胺(BACA)。在模拟体液的作用下,前者仍保持完整形态,而后者完全降解。研究人员进一步研究了物理交联点(离子交换)和化学交联点(二硫键-巯基交换)破坏对凝胶性能的影响。
3. 降解过程中的粘接性能变化
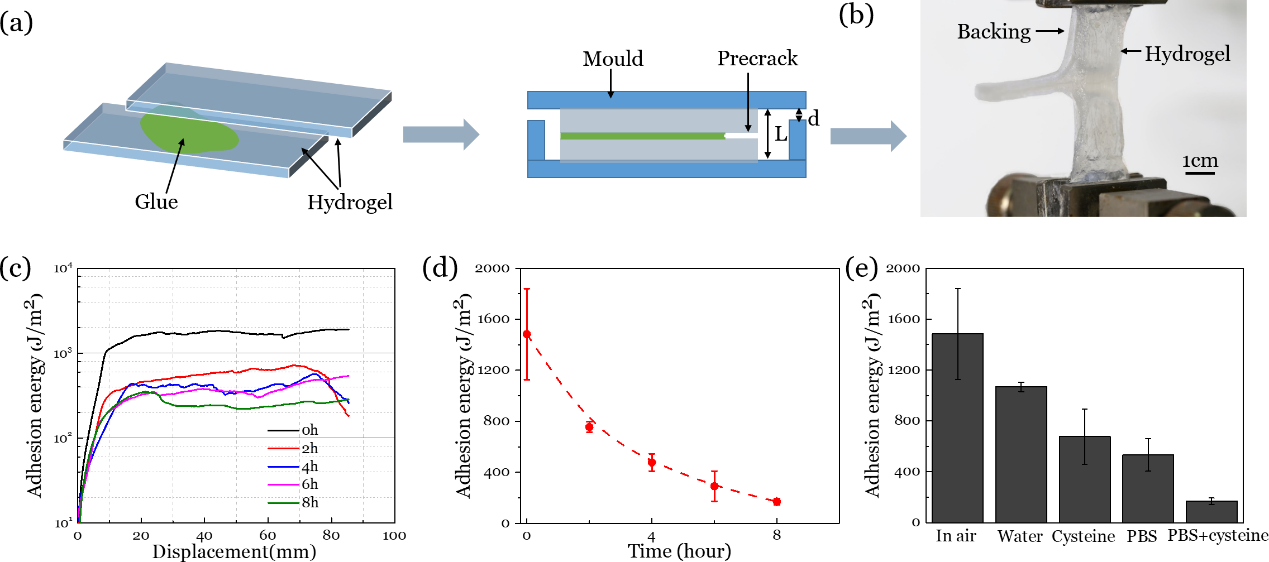
随着水凝胶的降解,其本体的断裂韧性降低,导致粘接能随时间逐渐降低。不同的溶液对于水凝胶的降解效果不同,引起的粘接性能变化也有所不同。
4. 组织粘接
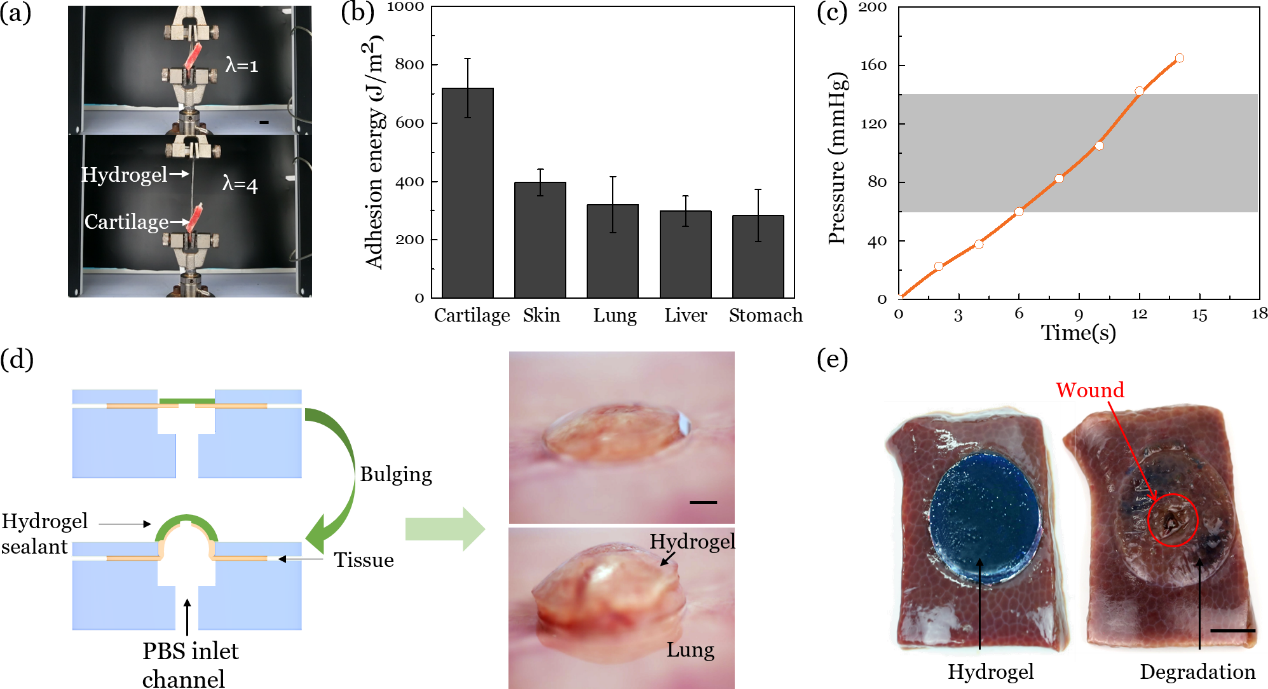
研究人员使用此凝胶实现了与不同生物组织的强韧粘接,且粘接能均超过200 J/m2。与软骨组织粘接后能承受较大自由拉伸(λ>4),与肺部粘接后能承受超过160 mmHg的水压。与组织粘接后实现了完全降解,在人体浓度氨基酸作用下,凝胶一个月后失去承载能力。该韧性可降解凝胶设计为生物组织修复提供了一种新材料和设计思路。
该研究工作发表于ACS Applied Bio materials。西安交通大学航天航空学院硕士生杨航为第一作者,西安交通大学青年教师唐敬达与哈佛大学锁志刚教授为论文共同通讯作者。
论文链接:https://pubs.acs.org/doi/abs/10.1021/acsabm.9b00103?from=timeline&isappinstalled=0
- 四川大学孙静/范红松团队 ACS Nano:兼顾抗菌活性与细胞保护功能的类酶水凝胶用于细菌性角膜炎中的角膜再生 2026-03-05
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- 北京化工大学岳冬梅教授团队 AFM:兼具卓越室温自修复、可回收与极端温度力学稳定性的高强度聚脲弹性体 2025-12-11
- 吉林大学孙俊奇教授课题组 NSR:基于强韧且可变形的纳米相区制备超高强度和超高韧性的可逆交联塑料 2025-11-22
- 华南理工王小慧/雷泽芃教授 ACS Nano:兼具高强度、优异阻燃性、耐溶剂性和可化学回收的热加工型纤维素网络聚合物 2025-10-20
- 国立京都工艺纤维大学徐淮中团队 AFM:高精度3D打印制备可降解医疗器械 2026-01-04
