乳腺癌居女性癌症发病率首位。肿瘤转移导致乳腺癌患者死亡,是癌症治疗亟待攻克的重大难题之一。而肿瘤细胞迁移是肿瘤转移的关键步骤。众所周知,相比正常细胞,肿瘤细胞吸收更多水分子来满足细胞的快速增殖和转移,其利用细胞膜上的一种水通道蛋白(Aquaporins,AQPs)实现水的快速跨膜转运。诸多研究证明水通道蛋白3(AQP3,一种水通道蛋白亚型),是乳腺癌细胞迁移的重要因素。近来,研究发现AQP3不仅对水分子具有通透性,亦是H2O2分子的跨膜运输通道。AQP3作为H2O2分子运输通道,将细胞外由趋化因子CXCL12调控NADPH氧化酶2所产生的H2O2输送到细胞内,H2O2在细胞内氧化蛋白酪氨酸磷酸酶1B,并进一步激活磷脂酰肌醇3激酶/蛋白激酶B信号通路,促使癌细胞发生迁移(Mol. Cell Biol. 2016, 36, 1206-1218.)。因此,抑制AQP3活性,阻断乳腺癌细胞迁移信号,有望预防与治疗乳腺癌的转移。

图1. MCF-7细胞(A)、MDA-MB-231细胞(B)和4T1细胞(C)在PBS(I)、Auphen(II)和Auphen@pOMPC-Dex(III)孵育后的CLMS图像。

图2.(A)不同药物处理后MCF-7细胞迁移共聚焦图像。MCF-7细胞(B)、MDA-MB-231细胞(C)和4T1细胞(D)不同药物处理后细胞迁移的定量分析。
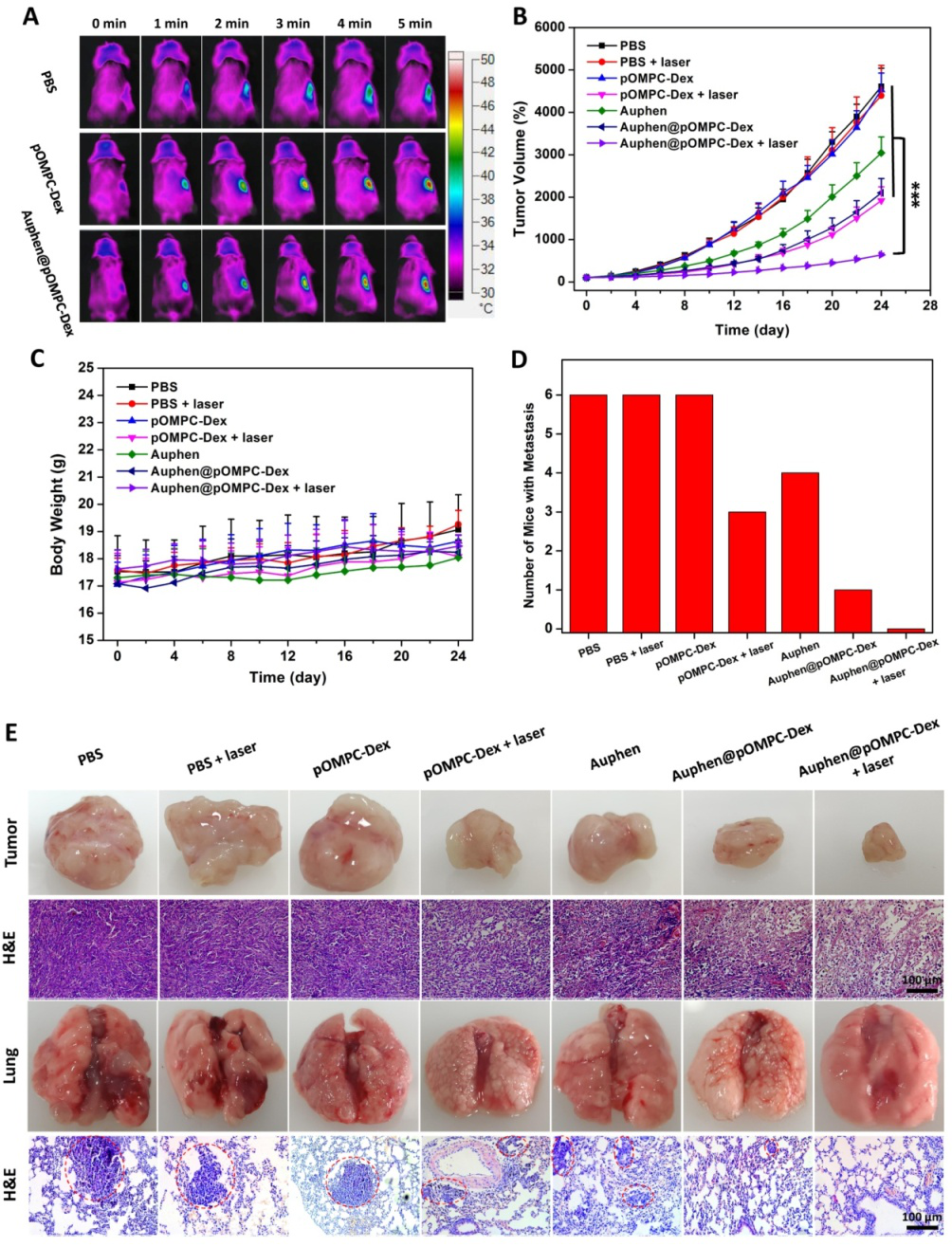
图3.(A)注射PBS、pOMPC-Dex和Auphen@pOMPC-Dex 24小时后,用808 nm激光(1.0 W cm-2)照射4T1荷瘤裸鼠体内热成像。(B)注射PBS、pOMPC-Dex、Auphen和Auphen@pOMPC-Dex的4T1荷瘤小鼠在有无光照射的情况下肿瘤体积的变化。(C)荷瘤小鼠对不同治疗的体重变化。(D)病理分析各组发生转移的小鼠数量。(E)各组肿瘤和肺的照片和H&E染色组织图像。
该研究结果为肿瘤转移的治疗提供了一种新的策略。天津工业大学高辉教授、天津理工大学安金霞讲师、中国医学科学院放射医学研究所杨丽军副研究员为该文章的共同通讯作者。该研究得到了国家自然科学基金委,天津市自然科学基金委的支持。
原文链接: https://www.sciencedirect.com/science/article/pii/S174270612200589X
- 华南师范大学先进信息材料课题组:介电润湿+像素模板快速可控制备聚合物纳米载体 2020-01-17
- 西南交通大学周绍兵教授团队在《Progress in Materials Science》发表亚细胞传递纳米材料综述论文 2019-11-01
- 中山大学帅心涛教授做客长春应化所应用化学系列讲座 2012-01-16
- 肿瘤转移无迹循?看我磷光照妖镜!- 李振/李倩倩/张玉峰联合团队《Sci. Adv.》:有机室温磷光纳米颗粒对肿瘤转移过程的检测与成像 2023-05-24
- 东华大学史向阳教授课题组《Nano Today》:在多功能载药PLGA纳米纤维环用于肿瘤治疗和抑制肿瘤转移上取得新进展 2021-03-22
- 西南交大周绍兵教授团队《Sci. Adv.》:聚合物囊泡同时引发内质网应激和自噬流阻断,有效抗肿瘤及抑制肿瘤转移 2020-08-05
