作为挤出式生物打印技术的一种变体,微流控同轴生物打印技术可以通过多层喷头同步挤出多种生物墨水、交联剂等组分,特别适用于构建单层或多层的中空管状结构,近年被广泛应用于组织工程化人工血管的构建研究中。然而,目前同轴生物打印的人工血管尚难以同时具备优异的机械性能和仿生功能等特征。在已有的研究基础(如Advanced Materials, 2018, 30, 1706913)上,哈佛医学院Y. Shrike Zhang教授课题组联合麻省理工学院赵选贺教授课题组设计了一种基于海藻酸盐和明胶天然聚合物的高细胞相容性强韧双网络水凝胶,用于高通量微流控同轴生物打印功能化的单层及双层中空血管组织,以分别模拟天然静脉及动脉,实现了解剖结构、机械性能及重要血管功能的仿生。
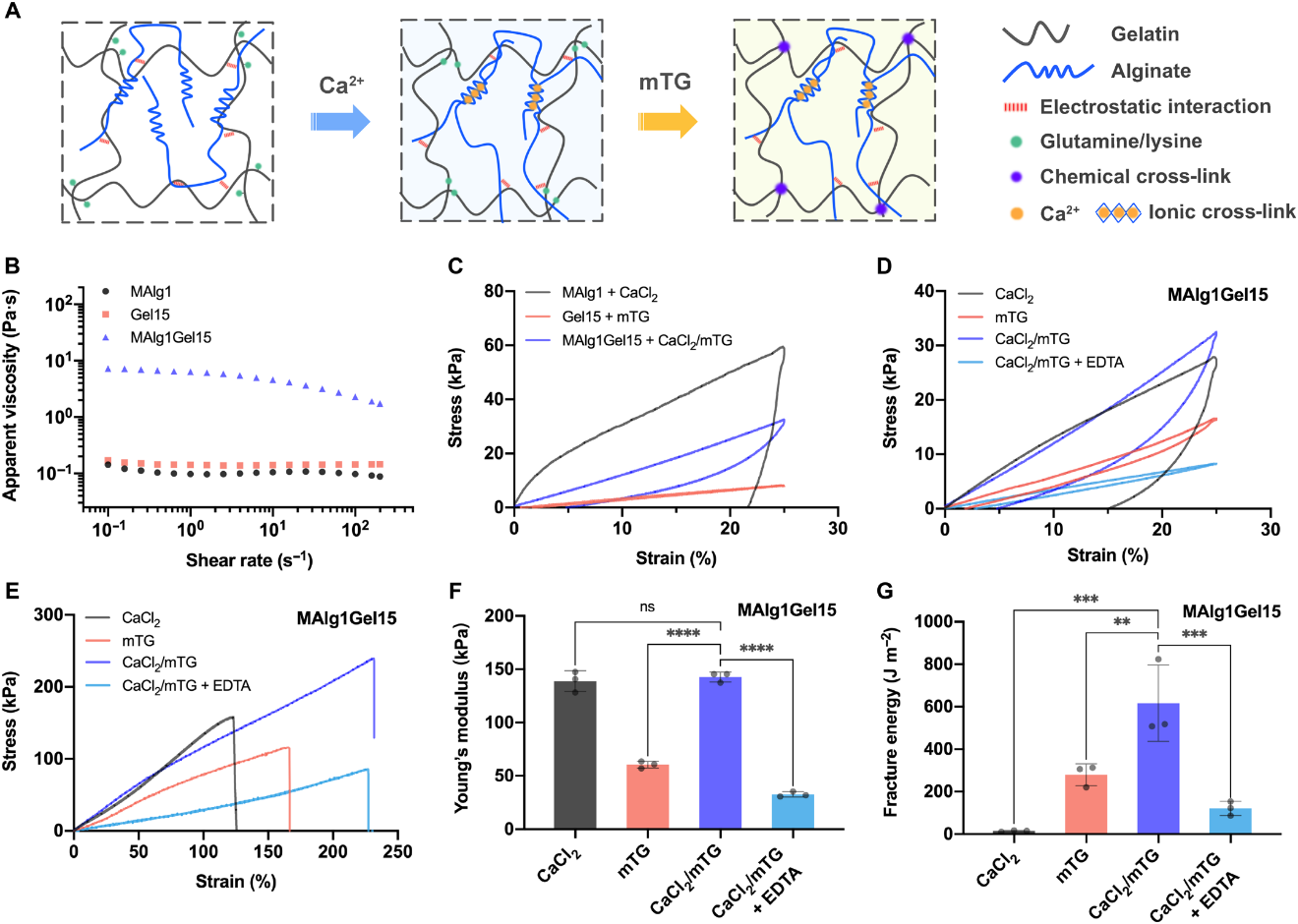
图1. 坚韧天然双网络水凝胶生物墨水的设计与机械性能表征
此双网络水凝胶通过Ca2+物理交联的海藻酸盐形成第一级网络,以微生物转谷氨酰胺酶(mTG)化学交联的明胶 (gelatin)(或明胶甲基丙烯酰(GelMA))形成第二层网络,原材料均为天然聚合物,且mTG为FDA批准的酶,整体生物相容性相比于传统双网络水凝胶较佳。海藻酸盐和明胶之间存在强静电作用,在0.1 s-1剪切速率下,两者混合水凝胶溶液的表观粘度为单组分的40倍。在双网络水凝胶中,第一级网络由致密可逆离子交联形成,大幅度提升了水凝胶的刚度与能量耗散的能力;第二级网络由酶引发的稀疏共价交联组成,赋予了水凝胶良好的弹性和柔性。因此,该双网络水凝胶表现出了优异的机械性能,相对于单组分水凝胶,它具有更高的强度和可拉伸性。此外,其高效的能量耗散机制和强化的可拉伸性赋予了水凝胶出色的断裂能(616.3 J·m-2)。

图2. 微流控同轴挤出式生物打印中空导管及其机械性能表征

图3. 微流控同轴挤出式生物打印人工静脉的结构及生物学功能表征
研究者在单层导管管腔内和管壁外分别接种薄层的静脉内皮细胞和平滑肌细胞以模拟天然静脉,内皮细胞通过注射器腔内推注细胞悬液完成接种;至于平滑肌细胞的接种,研究者则是将打印后的单层导管置于特定的凹陷疏水模具中,使细胞选择性地贴附在亲水性的水凝胶管壁外,最终两种细胞分别在管壁内、外实现了密集的粘附,解决了细胞难以接种于水凝胶管壁的难题,细胞活死实验表明单层导管的细胞相容性优异。免疫蛋白荧光染色证明,内皮细胞间存在紧密的细胞间连接以保证内皮细胞发挥相关功能,并活跃合成层粘连蛋白;平滑肌细胞表达出了致密的α-平滑肌肌动蛋白和微管蛋白,染色结果证实了人工血管腔内功能性内皮层和外壁平滑肌层的形成。类似于天然血管,人工血管内表面的内皮层作为血管屏障,在控制生物分子、营养物质和细胞的外渗方面发挥着关键作用。渗透性实验表明,含有内皮细胞层的人工静脉有效的延迟了荧光分子的外渗速度,发挥了内皮层的功能。
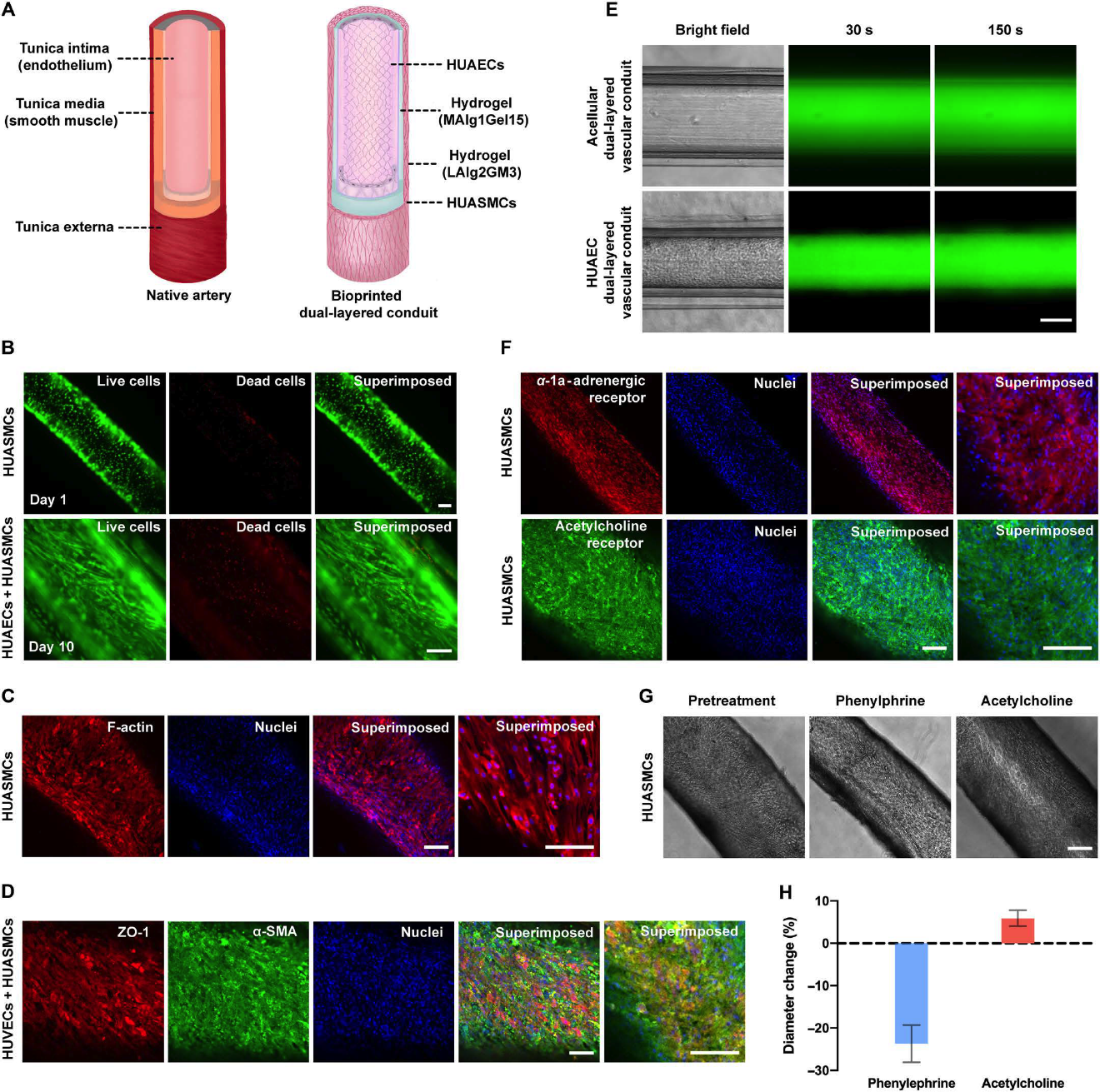
图4. 微流控同轴挤出式生物打印人工动脉的结构及生物学功能表征

图5. 微流控同轴挤出式生物打印人工动脉的体外、离体及体内应用
通过体外、离体及体内实验,该人工血管表现出了作为临床前体外器官模型和体内组织移植物的应用潜能。作为体外模型应用上,研究者通过SARS-CoV-2伪病毒(pCoV-VP)感染来研究人工血管的直接反应,并采用两种临床批准用于COVID-19的抗病毒药物瑞德西韦 (RMD) 和阿莫地喹 (ADQ) 处理感染后的血管,以观察抗病毒药物的有效性。pCoV-VP 感染前的染色表明,接种于人工血管的平滑肌细胞和内皮细胞高表达了SARS-CoV-2感染的关键受体—ACE2。病毒处理后实验表明,人工血管容易受到SARS-CoV-2感染,并且在抗病毒药物存在的情况下,pCoV-VP 的细胞病变作用降低,细胞活性和代谢活性明显提高。为了探索该生物打印的人工血管做为组织移植物的潜力,研究者分别进行和离体和体内吻合实验。首先,通过不同管径的人工血管分别与直径约1 mm的离体小鼠主动脉和直径约5 mm的离体人静脉通过组织胶水进行吻合,并灌注以荧光染料,观察到染料流通通畅,在吻合口处或血管壁处均未发现泄漏;其次 ,在活体小鼠中,将人工血管移植至小鼠腔静脉断端,打开血管夹后,发现血流流通通畅无泄漏,因此初步证明了其作为组织移植物的可能性。
原文地址:https://www.science.org/doi/10.1126/sciadv.abq6900
- 南京农大胡冰教授团队 Small:天然聚合物直径分布异质性增强可食用生物塑料膜性能 2024-12-16
- 北理工陈煜教授团队《Polym. Rev.》综述:基于天然高分子的物理水凝胶构建与应用 2022-10-26
- 哈工大贺强教授课题组《Adv. Mater.》综述:生物医用微纳米马达在克服生物屏障和体内成像的研究进展 2020-06-28
- 北理工陈煜/积水潭医院李波 CEJ: 仿蜗牛粘液强粘附水凝胶髓内钉止血涂层 2025-02-05
- 长安大学颜录科、西工程大张鹏飞 JMCA:自修复、抗变形MXene双网络水凝胶用于稳定太阳能驱动界面蒸发 2025-01-27
- 湖工大李学锋/北理工夏敏 Nano Lett.:坚固、抗污的亲水微凝胶增强双网络水凝胶 - PVDF互穿微滤膜 2024-12-16
- 深圳大学微流控与软物质课题组 AFM:多材料DLP生物打印构建具有可灌注网络的多组分异质水凝胶 2024-04-17
