仰大勇/李凤 Nano Today:基于DNA-高分子纳米复合体的双佐剂疫苗用于肿瘤免疫治疗
2023-12-05 来源:高分子科技
近期,天津大学/复旦大学仰大勇教授和北京化工大学李凤教授针对免疫抑制肿瘤微环境影响肿瘤免疫治疗效果的难题,利用DNA级联组装与动态硼化学,发展了基于DNA-高分子纳米框架的双佐剂肿瘤疫苗,通过肿瘤免疫微环境重编程,实现了高效的肿瘤免疫治疗。仰大勇教授和李凤教授为共同通讯作者。李凤教授和硕士研究生丁小惠为共同第一作者。研究得到国家自然科学基金等资助支持。
肿瘤免疫微环境对肿瘤的免疫治疗效果至关重要。大多数肿瘤微环境处于免疫抑制状态,严重影响了的肿瘤的免疫治疗效果。Toll样受体 (Toll-like receptor) 是参与非特异性免疫(天然免疫)的一类重要跨膜识别受体,Toll样受体的激活对于诱导先天性和适应性免疫反应至关重要,在机体免疫防御中发挥着重要作用。Toll样受体激动剂可特异性识别Toll样受体,激活免疫细胞的应答,从而对肿瘤免疫微环境进行重编程,在肿瘤免疫治疗中显示出巨大的潜力。
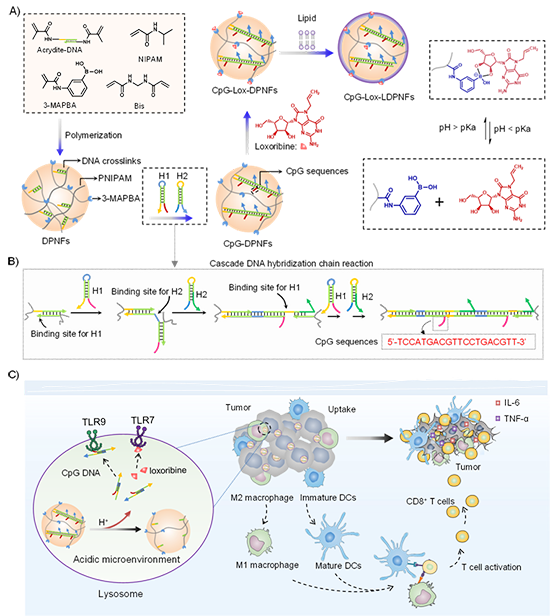
图1. 基于DNA-高分子纳米复合体的双佐剂疫苗和肿瘤微环境重编程机制
原文链接:https://www.sciencedirect.com/science/article/pii/S1748013223003109
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 东华大学郭睿教授/史向阳教授课题组《ACS AMI》:树枝大分子包裹铜铂双金属纳米酶用于肿瘤微环境调控光热/催化疗法 2025-06-19
- 上海市第一人民医院马小军/东华大学何创龙 Bioact. Mater.:TME响应复合水凝胶靶向抑制MYC驱动型骨肉瘤生长与转移 2025-01-17
- 天工大高辉教授团队 AHM:提升结直肠癌的抗血管生成基因疗法重塑炎症和免疫抑制性肿瘤微环境 2024-12-26
- 山东大学崔基炜教授团队《Adv. Mater.》:“以瘤治瘤”的水凝胶疫苗 - 实现个性化肿瘤免疫治疗新突破 2025-10-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 东南大学葛丽芹教授团队 Adv. Sci.:开发甘露糖修饰金属-多酚微胶囊 重塑巨噬细胞表型助力肿瘤免疫治疗 2025-03-05
