自2011年美国食品药品监督管理局(FDA)批准Ipilimumab作为ICB药物治疗转移性黑色素瘤以来,以CTLA4抗体和PD-1/PD-L1抗体为代表的免疫检查点治疗在癌症治疗中取得了早期成功。然而,患者个体差异以及免疫抑制性肿瘤微环境(ITME)经常导致ICB疗法的失败。目前,单一ICB治疗的响应率只有不到20%。有研究报道,慢性炎症是肿瘤进展和复发的主要促进因素。实际上,肿瘤免疫抑制微环境的形成与特定炎症细胞和相关细胞因子的长期塑造密切相关,主要炎症细胞包括髓源抑制细胞(MDSC)、癌相关成纤维细胞(CAF)、肿瘤相关巨噬细胞(TAM)、肿瘤相关中性粒细胞(TAN)和T淋巴细胞亚型,主要炎症调节因子包括转化生长因子β (TGF-β)、白细胞介素10 (IL-10)、IL-17、IL-6和IL-23。在长期塑造下TME最终形成抗肿瘤免疫与促肿瘤炎症的平衡,进而发展为免疫豁免型或者免疫沙漠型的肿瘤微环境,从而显示出了极强的对ICB治疗的沉默性。因此,有效逆转慢性促肿瘤炎症是优化ICB疗法效率的一种有吸引力的策略。
然而,目前鲜有报道共递送炎症调节分子和ICB治疗抗体的纳米体系。一方面,当前众多的肿瘤纳米医学的研究主要集中在针对如何有效的激活抗肿瘤炎症方面,而对慢性促肿瘤炎症调控的研究重视不够。另一方面,传统药物递送体系低效的药物负载能力不能满足共递送的要求。当前纳米颗粒的载药形式主要以吸附和共沉淀的方式为主,不仅远不能满足临床转化对药物载药量的要求,还非常容易导致药物的提前泄露。此外,很多载药纳米体系的设计往往注重于结构多样性和复杂性,以实现更加复杂的药物递送能力,但是忽视了载药量是否能达到治疗的需求这一关键问题。
为了解决上述问题,近日,重庆大学蔡开勇教授/冯茜副教授团队及中国科学院大学重庆学院于永生副研究员团队报道了一种通过模板辅助自编织技术制备的GSH响应性和H2S自产生特性的丝素蛋白纳米笼,用于共递送炎症调节分子BetP和ICB抗体,实现对ICB治疗的优化。在该研究中,作者开发了模板辅助自编织技术,实现在微观尺度下对丝素蛋白相分离的引发、控制以及纳米笼的编织过程。随后,在经过载药、固化和HA表面修饰后,得到了高载药量靶向递送丝素蛋白纳米笼HA-gNCs。平均载药量为15.5%,药物负载效率超过88%,并且具有高产率(80%)和显著的批次间稳定性。同时,由于应用了GSH敏感性硫代碳酸酯衍生物(yne-BDATC)作为交联剂固化SF编织壳层,因此HA-gNCs显示出了优异的GSH响应性药物释放特性以及GSH响应性H2S生成特性。体外实验表明,HA-gNCs具有优异的肿瘤细胞靶向递送和肿瘤细胞特异性H2S累积效应,可以实现H2S浓度依赖性的炎症调控和诱导肿瘤细胞线粒体功能紊乱,从而逆转促肿瘤慢性炎症以及产生呼吸功能长期剥夺(Respiratory deprivation)后的肿瘤细胞免疫原性死亡。体内实验表明,BetP@HA-gNCs具有时序性重塑(Chronological remodeling)促肿瘤炎症微环境的能力,从而高效的实现对ICB治疗的优化过程,产生最优抗肿瘤免疫的激活。相关工作以“Glutathione-Responsive and Hydrogen Sulfide Self-Generating Nanocages Based on Self-Weaving Technology To Optimize Cancer immunotherapy”为题发表在 ACS NANO,重庆大学苟双全博士及耿文博博士为本文共同第一作者,重庆大学蔡开勇教授、冯茜副教授、中国科学院大学重庆学院于永生副研究员为本文共同通讯作者。
文章要点
一、模板辅助自编制技术制备多功能丝素蛋白纳米笼
从分子聚集态的角度来看,通过再生丝素蛋白(RSF)溶液制备具有典型β-sheet结构的丝素蛋白宏观和微观体系,如水凝胶、支架和微纳米体系等,丝素蛋白分子链都将经历拉伸(Stretching)和重排(Alignment)过程。因此,对丝素蛋白分子链拉伸和重排过程的调控,是制备丝素蛋白基材料的关键。然而,实现这个过程的可控性和可重复性是相当具有挑战性的。这是由于无法充分控制初始拉伸和随后的排列过程,或者无法完全分离拉伸和排列阶段。在本研究中,作者提出了模板辅助的可控自编织策略,以实现微观尺度下对拉伸和重排过程的分离,构筑丝素蛋白纳米有序结构。首先为了保持SF分子链的稳定拉伸结构,作者制备了包含SF的反相微乳液(RME),以此将SF分子以拉伸状态稳定在最小能量状态的RME相界面。然后引入了悬浮有CaCO3纳米颗粒的水溶液来打破RME系统的平衡,从而导致SF分子链与溶剂之间界面间隙(Interface gap)的迅速增大,进而达到增强SF分子链疏水相互作用的效应,促进SF分子链内和链间的重新排列产生相分离。由于CaCO3纳米颗粒和SF分子链之间界面低能量表位的存在,因此SF分子的相分离重排过程在纳米界面上迅速进行,从而产生编织效应,在CaCO3纳米颗粒周围形成稳定的SF编织壳层。随后,使用酸性溶液蚀刻CaCO3纳米核心,得到最终的SF纳米笼(NCs)。在装载所需药物后,通过yne-BDATC与SF之间炔基-硫醇的点击化学反应实现纳米笼的交联固化,形成GSH响应和H2S气体自发生成的NCs(gNCs)。最后,在gNCs表面修饰HA分子,从而形成更稳定、更紧凑的具有CD44介导的肿瘤靶向能力的纳米笼HA-gNCs。制备过程如图1所示。
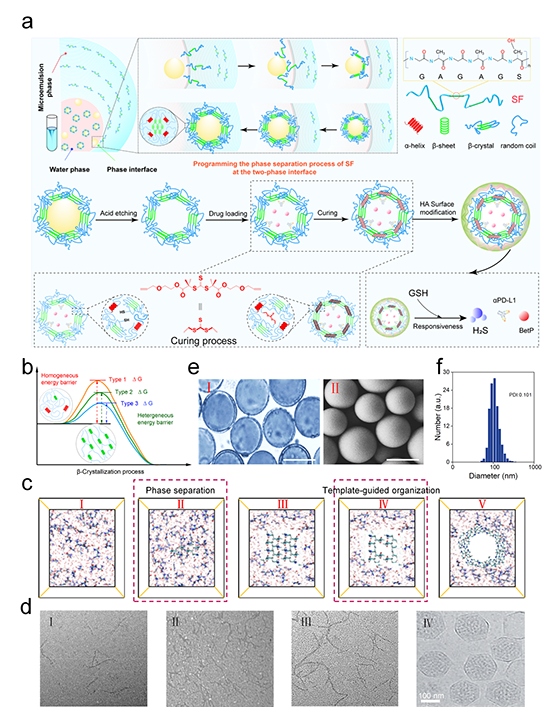
图1. 模板辅助自编织技术制备HA-gNCs示意图及其相应表征
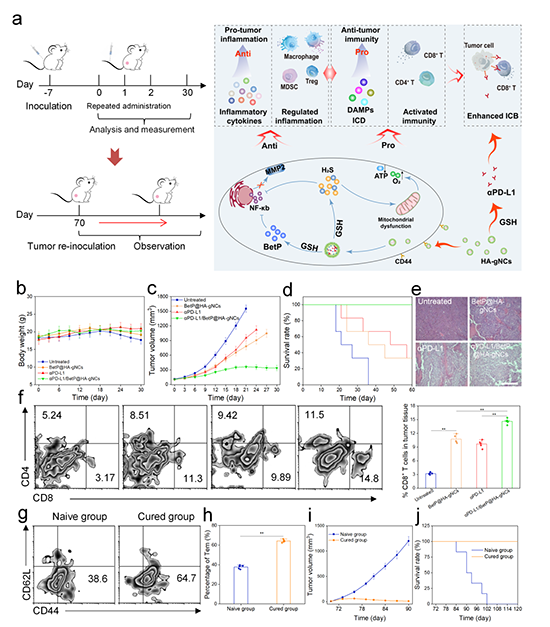
二、时序性介导抗肿瘤免疫的激活
体外实验表明,HA-gNCs显示出了优异的肿瘤细胞靶向特性和慢性炎症调控能力,以及明显的肿瘤细胞内H2S累积效应,并且累积H2S对肿瘤细胞的作用显著出了时间依赖性,短时间内可以显著诱导肿瘤细胞线粒体功能紊乱,抑制炎症相关通路的表达,并且抑制氧耗,使肿瘤细胞能量代谢转向糖酵解。而长时间的线粒体功能紊乱则导致肿瘤细胞的免疫原性死亡。此为HA-gNCs对肿瘤的一级时序调控。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.3c08939
- 东华大学曹雪雁副研究员/史向阳教授团队 AHM:恢复巨噬细胞吞噬功能的仿生纳米凝胶用于乳腺癌磁共振成像和化学免疫治疗 2023-08-09
- 北京纳米能源所董凯团队 Adv. Mater.:提高半晶生物聚合物机电转换性能的通用取向工程策略 2025-08-19
- 广西大学林宝凤教授团队:基于废弃蚕茧编织的凝胶“一网扫净”难处理的超细纳米颗粒和有害污染物 2025-03-24
- 苏大李刚、中山大六院黄丹丹/郅敏 IJBM:丝素蛋白搭载CUR/5-ASA双药肛瘘支架 2024-11-05
- 华南理工殷盼超团队 J. Membr. Sci. :混合基质膜中气体传输的微观机理 2023-06-10
- 华工殷盼超课题组《CCS Chem.》:聚合物基配位金属纳米笼复合材料构筑玻璃体高分子 2022-02-17
- 华南理工大学殷盼超教授JPCL封面文章:纳米笼表面多级受限大分子配体溶液动力学 2021-06-08
