武汉大学张先正教授/钟振林教授/喻爱喜教授/吴猛教授 ACS Nano:人工淋巴结用于增强胶质母细胞瘤的术后免疫治疗
2024-05-09 来源:高分子科技
肿瘤免疫治疗的疗效在很大程度上取决于肿瘤特异性CD8+ T细胞的活化状态,而此类细胞的激活依赖于其与抗原呈递细胞(APCs)之间的相互作用,通常发生在邻近的淋巴结内。然而,肿瘤细胞可以通过多种途径驯化淋巴结内的APCs和其他免疫细胞,从而形成免疫抑制性淋巴结微环境,甚至形成转移前生态位。因此,向肿瘤内引入人工淋巴结的免疫治疗策略能够实现直接的T细胞激活,从而避免淋巴结免疫抑制性微环境对T细胞活化的限制。
基于此,武汉大学张先正教授、钟振林教授联合武汉大学中南医院喻爱喜教授、吴猛教授多学科合作报道了一种原位喷涂形成的免疫治疗凝胶,该免疫治疗凝胶能够通过模拟淋巴结的功能,直接激活T细胞,从而防止胶质母细胞瘤的术后复发(图1)。

图1 bALG@DT-Exo凝胶增强胶质母细胞瘤术后免疫治疗的示意图
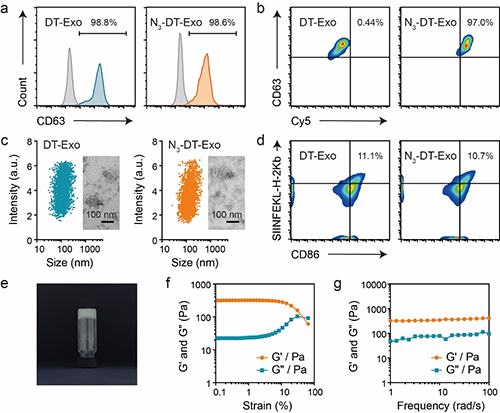
图2 bALG@DT-Exo凝胶的制备与表征
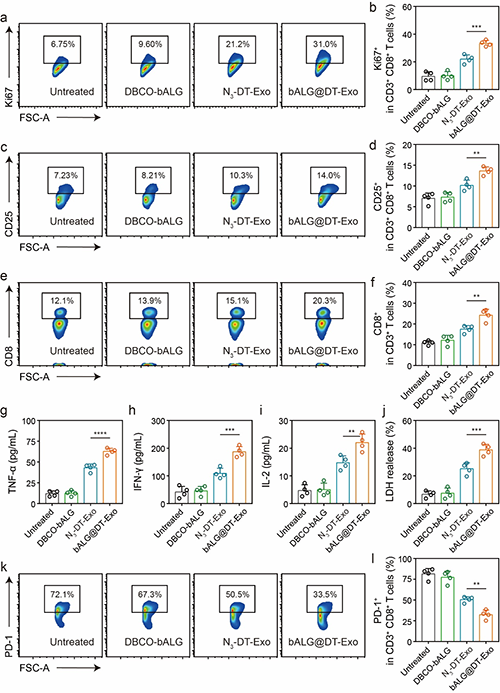
图3 bALG@DT-Exo凝胶介导的T细胞抗肿瘤应答
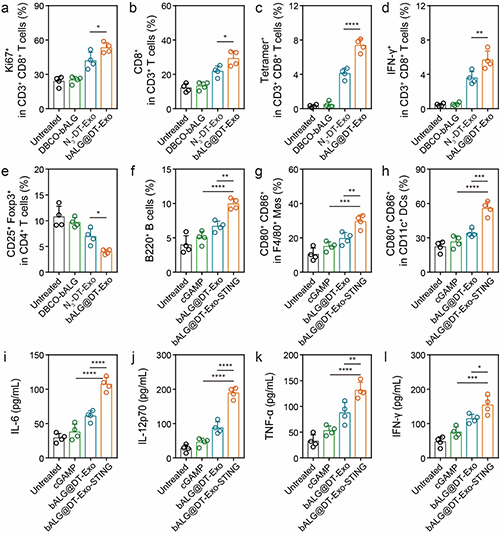
图4 基于bALG@DT-Exo的凝胶诱导的体内抗肿瘤效应
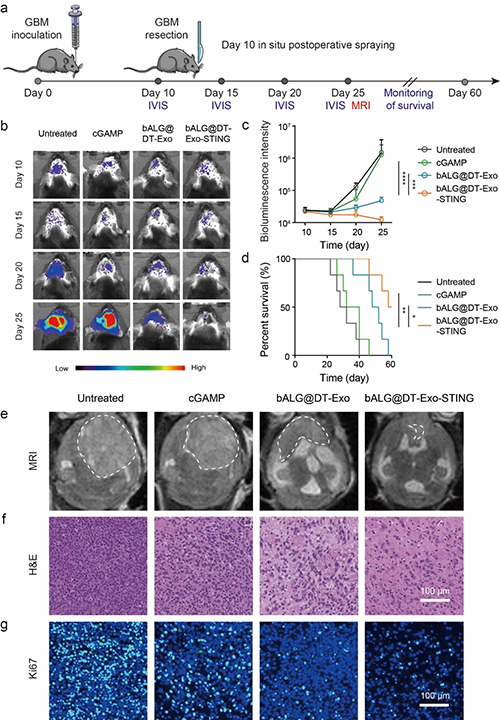
图5 bALG@DT-Exo-STING凝胶在原位胶质母细胞瘤小鼠术后模型中的抗肿瘤疗效
综上所述,本研究构建了一种原位喷涂形成的免疫治疗凝胶,该凝胶能够作为人工淋巴结,增强T细胞介导的免疫应答。这种原位形成的凝胶有望作为模块化的免疫治疗平台,用于重编程免疫细胞的功能,尤其适用于过继性免疫细胞疗法。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c02425
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 哈佛大学医学院陶伟教授团队《PNAS》:原位喷涂的黑磷镇痛水凝胶用于糖尿病溃疡治疗的初步研究 2020-11-23
- 清华大学杜娟娟/军事医学研究院杨益隆合作团队 ACS Nano:一种激活两条天然免疫途径的无佐剂纳米疫苗 2024-03-19
- 深大附属华南医院马婧、法国CNRS彭玲团队 AM: PD-L1抗体偶联PAMAM树形分子纳米体系抑制癌症糖酵解和促进免疫应答 2023-12-17
- 山东大学崔基炜教授团队 ACS Nano: 硬度可调的聚乙二醇纳米颗粒调节纳米-生物相互作用,增强靶向药物递送 2025-06-12
- 山东大学崔基炜教授团队AHM:低免疫原性靶向聚乙二醇纳米粒子用于光热-免疫协同治疗 2025-01-08
- 山东大学崔基炜教授团队AHM:凝聚体衍生的聚乙二醇纳米颗粒用于联合肿瘤治疗 2025-01-08
