临床上可用的抗真菌药物稀缺,加上副作用频发和真菌耐药性的加速出现,导致耐药真菌感染成为全球公共卫生安全的严峻威胁,亟需研究新型抗真菌药物。由于纳米结构的独特优势,宿主防御肽组装体是抗真菌药物的理想替代品之一,但其在体内稳定性、生物安全性、简易合成及批次间一致性方面仍面临挑战。因此,亟需有效策略克服上述挑战,设计并合成兼具生物安全性和体内抗耐药真菌感染能力的宿主防御肽模拟物组装体。
针对上述挑战,刘润辉教授课题组设计并合成了一种聚肌氨酸功能化宿主防御肽模拟物组装体,并开发了一种类嵌段聚-β-多肽的一锅法简便合成策略。合成的聚-β-多肽组装体通过细胞器破坏和产生高水平活性氧的多靶点作用机制,展现出对耐药真菌的强效抗菌活性,可有效清除生物被膜,同时兼具优异的生物安全性和体内抗真菌疗效。该工作为设计自组装抗真菌剂和治疗耐药真菌感染提供了新思路。

2025年5月6日,该研究成果以“Self-assembled poly(sarcosine) functionalized host defense peptide-mimicking poly-β-peptides for combating drug-resistant fungal infection”为题发表在Advanced Functional Materials (Adv. Funct. Mater. 2025, 2424125. DOI: 10.1002/adfm.202424125)。
作者通过整合聚-β-多肽和聚(肌氨酸)的优势,设计了自组装聚(肌氨酸)功能化宿主防御肽模拟物,并建立了类嵌段聚-β-多肽的单锅敞口合成方法。合成的聚-β-多肽组装体具有出色的批次间重现性,对耐药真菌具有高抗菌活性和高选择性,能有效根除成熟生物被膜,并表现出出色的生物安全性和体内抗真菌功效。值得注意的是,由于具有与细胞器破坏和高水平活性氧生成相关的多靶点作用机制,真菌无法对组装体产生耐药性(图1)。

图1:用于抗耐药真菌感染的聚肌氨酸功能化自组装聚-β-多肽的设计与合成策略。
以4-叔丁基苄胺为引发剂,在CHCl3/H2O(95/5)体系中,通过Sar NNCA与β-NTAs的单锅敞口共聚,可成功制备聚肌氨酸(Psar)功能化聚-β-多肽。动力学研究表明,Sar NNCA反应活性显著高于β-NTA单体(如Bn-β3-LCHG NTA),形成类嵌段结构。考虑到HDP通常具有正电荷/疏水性关键结构,进一步引入带有侧链NHCbz取代基的Cbz-β2-DAP NTA单体,证实该聚合方法可用于快速合成聚肌氨酸功能化HDP模拟聚-β-多肽。通过调节单体进料比,成功构建分子量可控、分散度较窄且单体比例可调的Psar-聚-β-多肽库,表明聚合可控性(图2)。

图2:Sar NNCA与β-NTAs的单锅敞口共聚。
以tBuBn-Psar10-b-P(Bn-β3-LCHG)10为模型,研究了类嵌段Psar-聚-β-多肽自组装成纳米结构的能力。两亲性类嵌段共聚物可在H2O/DMSO(70/30)中自组装形成纳米胶束,并在15天测试期间内保持稳定。五批次聚合产物GPC曲线高度重合,分子量及分散度几乎相同,证明聚合具有出色的重现性。这一结果表明,该聚合策略可用于合成类嵌段Psar-聚-β-多肽,可进一步通过自组装形成纳米结构,在药物封装和递送等多种应用中具有巨大潜力(图3)。

图3:类嵌段聚(肌氨酸)功能化聚-β-多肽的自组装研究。
随后,作者通过模拟HDP设计并合成了一种荧光染料标记的聚肌氨酸功能化聚-β-多肽组装体(Dye-Psar10-b-Pdap10 NPs)。该纳米胶束展现出出色的抗真菌性能,对白念珠菌和新型隐球菌的MIC值为0.2-1.56 μg/mL,与临床抗真菌药物两性霉素 B(AmpB)的活性相当;对临床耐药菌株以及其他耐药念珠菌,包括格拉布氏念珠菌和热带念珠菌保持高效活性。杀菌动力学显示2×MFC浓度下2小时即可完全完全根除白色念珠菌。此外,胶束还具有优异的生物相容性,抗真菌选择性指数远高于AmpB,表明其出色的治疗潜力(图4)。

图4:聚(肌氨酸)功能化HDP模拟聚-β-多肽组装体的制备与抗真菌活性研究。
进一步评估Dye-Psar10-b-Pdap10 NPs的抗生物被膜活性。实验显示,50 μg/mL的聚合物胶束即可根除白色念珠菌成熟生物被膜,显著优于临床药物卡泊芬净和氟康唑(200 μg/mL仍无明显效果)。活/死染色荧光共聚焦成像表明该材料能破坏生物被膜结构并杀灭内部真菌,而传统药物处理后仍有大量活菌残留。SEM表征同样显示NPs能有效破坏生物膜的结构完整性,并根除生物膜中的菌丝和真菌细胞。上述实验结果证明了聚-β-多肽胶束在根除成熟生物被膜和治疗生物被膜相关感染方面的潜力(图5)。
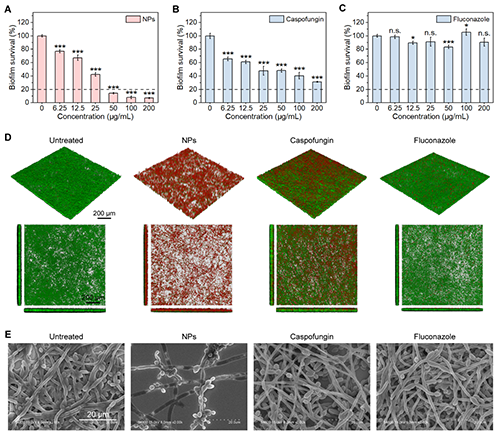
图5:聚-β-多肽组装体的抗生物被膜活性研究。
对Dye-Psar10-b-Pdap10 NPs的抗真菌机制展开研究。延时荧光共聚焦成像显示,NPs能直接穿透真菌细胞膜进入胞质,而没有在细胞膜上富集。膜去极化实验表明NPs与细胞膜没有明显的相互作用。进入细胞内部后,NPs破坏了真菌细胞核、线粒体等关键细胞器的完整性,同时导致胞内ROS水平显著升高。ROS清除剂NAC可使其MIC值从1.56 μg/mL升至800μg/mL,证实高水平ROS是其杀菌的关键因素。扫描电镜观察显示,NPs处理后的真菌细胞膜仅出现轻微形变,膜完整性保持完好。上述实验结果共同表明,NPs具有与细胞器破坏和高水平活性氧生成相关的多靶点作用机制。与传统抗真菌药物氟康唑相比,这种多模式抗真菌机理使NPs不易诱导真菌产生耐药性(图6)。
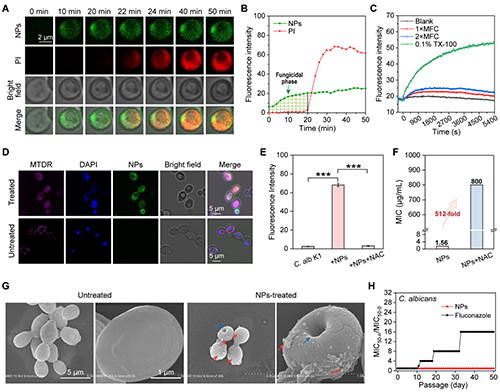
图6:聚-β-多肽组装体的抗真菌机理研究。
在皮肤擦伤感染模型中,NPs处理使感染皮肤的真菌负荷明显降低,并显著减少组织菌丝入侵和炎性细胞浸润,与抗真菌药物咪康唑疗效相当。肺部感染模型中,NPs和AmpB处理都能显著减少感染器官的真菌负荷。值得注意的是,静脉注射剂量高达120 mg/kg的NPs,小鼠的血清生化指标和组织学分析均未观察到肝肾毒性。这些结果表明Dye-Psar10-b-Pdap10 NPs兼具出色的体内抗菌效果和生物安全性,具有治疗耐药真菌感染的巨大潜力。

图7:聚-β-多肽组装体的体内抗真菌功效及生物安全性研究。
华东理工大学博士毕业生谢佳洋是该论文的第一作者,华东理工大学周敏副研究员和刘润辉教授是论文的共同通讯作者。该研究得到了国家自然科学基金委、科技部等基金的资助。
论文链接: https://doi.org/10.1002/adfm.202424125
