由于椎间盘退变(IVDD)引起的下腰背疼痛已成为发病率最高的疼痛性疾病之一,给社会经济造成沉重的负担。作为椎间盘(IVD)的重要结构,髓核组织(NP)与纤维环(AF)和软骨终板(CEP)一起维持着脊柱的稳定性和生理功能。髓核细胞密度降低、基质金属蛋白酶等相关降解因子的过度表达是IVDD的主要表现,也是细胞外基质中II型胶原(COL II)和糖胺聚糖(ACAN)的密度下降进而无法维持椎间盘正常生理功能的原因。当前临床治疗所使用的物理治疗、脊柱融合术或椎间盘切除术虽然取得一定的效果,但是并不能实现髓核组织再生,从根本上逆转IVDD。通过合适的组织工程材料向退变髓核组织递送髓核细胞或干细胞是提高髓核组织细胞密度,恢复细胞外基质合成的直接手段,近年来也被广泛研究。然而,递送过程中细胞泄露导致的异位成骨、体外扩增培养髓核细胞存在去分化的风险、干细胞的活性和分化能力会在递送后受到损害等问题在一定程度上限制了该方法的应用。研究表明存在于健康和退行性 IVD 中的干/祖细胞具有分化成髓核组织的潜能,是替代外源性细胞的理想细胞源。募集和促进这些细胞向髓核分化需要多种生物活性因子时序性参与,但目前仍缺乏既满足合适的活性因子释放动力学,又满足有效募集细胞、促进细胞生长浸润和向髓核分化的支架材料。
针对以上问题,华南理工大学国家人体组织功能重建工程技术研究中心曹晓东教授团队报道了一种顺序释放生物活性因子的可注射微孔性微凝胶组装体支架MA-TNS(图1),它能够促进细胞的浸润和长入,并通过快速释放基质细胞衍生因子-1a(SDF-1α)募集内源性干细胞,随后持续释放转化生长因子-β1(TGF-b1)促进干细胞向髓核分化,最终实现大鼠退变髓核再生和抑制食蟹猴腰椎间盘的进一步退变。该工作以“Injectable and Microporous Microgel Assembly with Sequential Bioactive Factor Release for the Endogenous Repair of Nucleus Pulposus”为题发表在国际权威期刊Advanced Functional Materials上(Adv. Funct. Mater. 2024, 2315592)上,曹晓东教授和博士后冯琦为该文的通讯作者,华南理工大学博士研究生罗惠彤为文章第一作者。
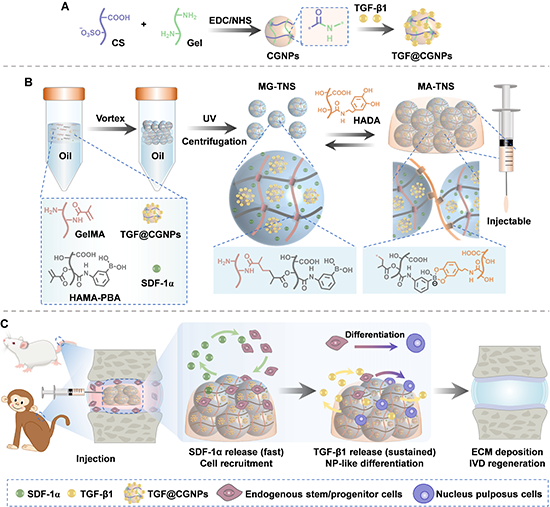
图1 顺序释放生物活性因子的可注射微凝胶组装体的制备及髓核修复示意图
为了实现SDF-1α和TGF-b1的顺序释放,研究团队首先制备硫酸软骨素/明胶复合纳米颗粒(CGNPs)负载生长因子TGF-β1,获得纳米粒子TGF@CGNPs(图1A)。随后,TGF@CGNPs和趋化因子SDF-1α共同封装到微凝胶中。该双活性因子负载的微凝胶(MG-TNS)以双键修饰的明胶(GelMA)以及双键和苯硼酸双修饰的透明质酸(HAMA-PBA)为基体材料,通过乳液法和光交联的方式获得(图1B)。微凝胶通过表面上的苯硼酸基团和作为组装剂的多巴胺修饰的透明质酸(HADA)发生苯硼酸酯键,形成具有连通微孔的微凝胶组装体支架(MA-TNS)。
纳米颗粒通过去溶剂化法获得,并以静电相互作用将TGF-b1负载于纳米颗粒上。TGF@CGNPs平均粒径为193.7 nm(图2)。
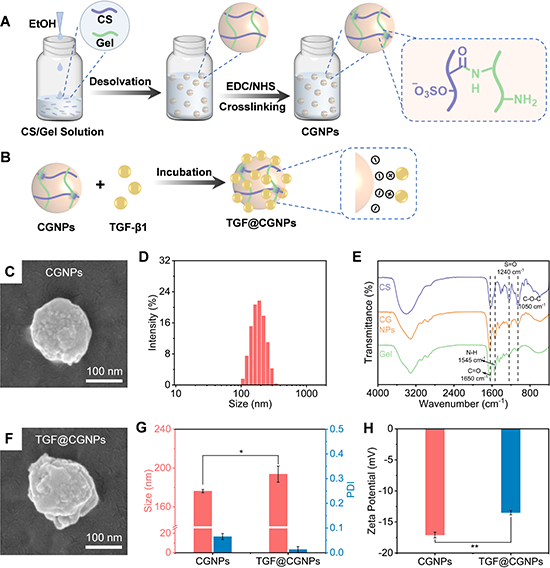
图2 负载TGF-β1的纳米颗粒的制备和表征
乳液法制备获得的双活性因子负载微凝胶平均粒径为132.6±20.9 μm,SDF-1α和TGF@CGNPs可均匀分散在微凝胶中(图3)。经苯硼酸酯反应获得的微凝胶组装体MA-TNS具有连通的微孔结构。在椎间盘自然载荷频率范围内(25-35 rad s-1)保持稳定的凝胶状特性。MA-TNS还具有良好的可注射、自愈合特性,能满足髓核修复的基本需求。此外,在活性因子释放方面,该组装体可实现SDF-1α在前期快速释放(7天后累积释放量为62.4%),TGF-β1随后持续性释放(28天累积释放量为46.5%),这有利于快速募集细胞和长期诱导细胞分化和促进细胞外基质沉积。
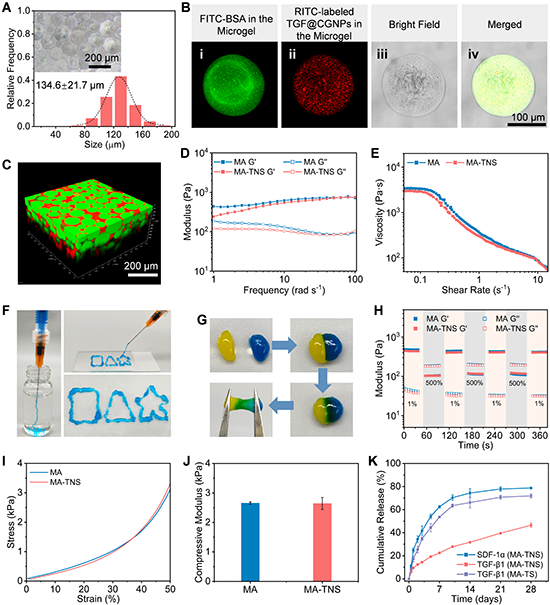
图3 顺序释放生物活性因子的微凝胶组装体MA-TNS的制备及理化性能表征
MA-TNS通过释放趋化因子具有良好的募集干细胞的能力。微凝胶组装体具有良好的细胞相容性,能够支持干细胞增殖。随着培养时间的延长,细胞生长进入微凝胶组装体内部,5天长入深度约为300 μm,且封装在微凝胶组装体中的生物活性因子对浸润深度没有显著影响。相比之下,相同组分制备的块状水凝胶会明显阻碍细胞浸润行为,细胞长入深度不随培养时间变化。这些发现表明具有连通微孔结构的微凝胶组装体有利于细胞浸润(图4)。
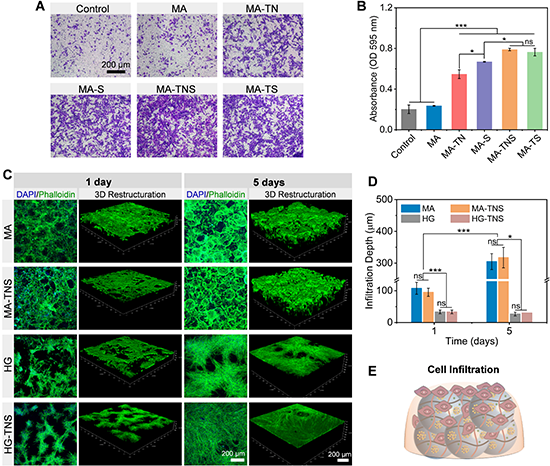
图4 微凝胶组装体募集干细胞以及促进细胞浸润长入的能力表征
在体外分化实验中(图5),培养7天和21天后,与其余组相比,含有TGF-β1的组中软骨标志性基SOX9、ACAN和COL II的表达水平明显上调,且这种上调效果随时间推移而增强。免疫荧光染色进一步表明,微凝胶组装体释放的TGF-β1显著促进了ACAN和COL II的表达。与TGF-β1和SDF-1α同时从组装体中快速释放的组别(MA-TS)相比,在纳米颗粒的帮助下,TGF-β1从微凝胶组装体(MATNS)中持续释放,能够在细胞培养过程中保持生物活性和有效浓度,使软骨标志性基因和蛋白高表达。因此,微凝胶组装体MA-TNS能够确保内源干细胞长期有效分化。
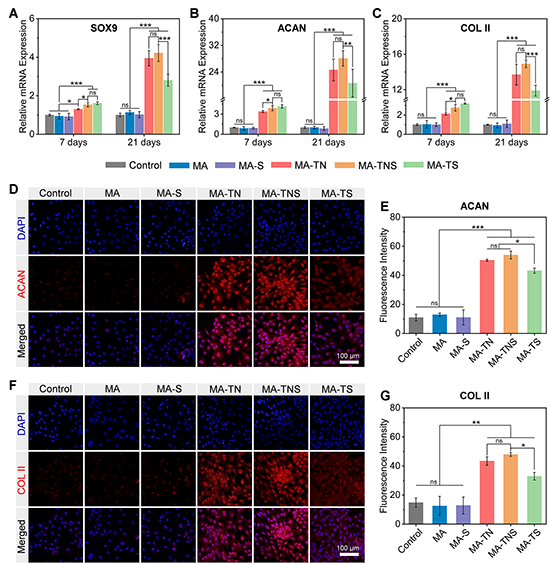
图5 顺序释放生物活性因子的微凝胶组装体体外诱导干细胞分化能力表征
为了评价 MA-TNS 在体内的治疗效果,研究团队采用针刺法在大鼠尾椎建立IVDD模型,并注射材料,并于术后5周和10周进行影像学和组织学分析(图6)。与其他实验组相比,髓核组织能维持较高的水合状态,结构较完整,组织界限清晰。免疫组化表明MA-TNS组髓核组织中COL II和ACAN含量明显较多(图7),说明双活性因子顺序释放微凝胶组装体能够显著改善髓核细胞外基质代谢平衡,实现髓核再生。
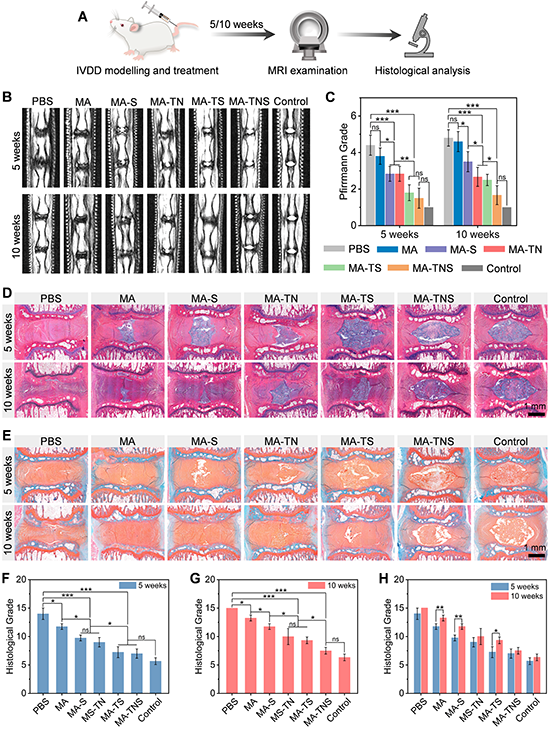
图6 微凝胶组装体修复大鼠尾椎效果表征

图7 微凝胶组装体修复大鼠尾椎免疫组化表征
与大鼠等小型啮齿类动物相比,食蟹猴的椎间盘在生物学和生物力学方面与人类椎间盘更为相近。研究团队进一步评估了材料体系对食蟹猴腰椎间盘退变的疗效(图7)。术后6周和25周结果表明MA-TNS这一双活性因子顺序释放微凝胶组装体能够抑制食蟹猴椎间盘进一步退变。本研究为组织工程退变椎间盘的功能再生提供了新思路,有望进一步应用于椎间盘退变的临床治疗中。
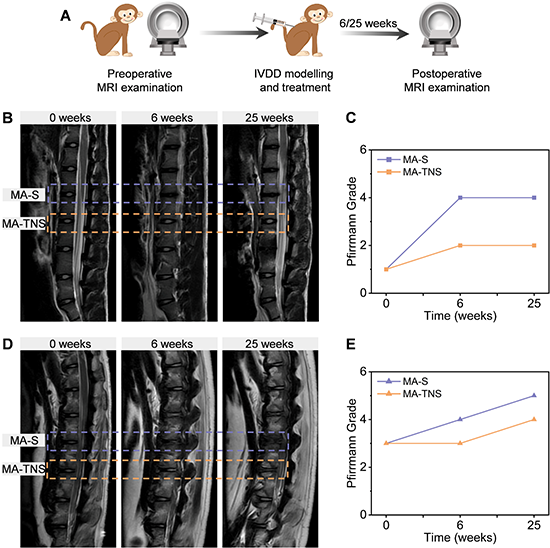
图8 微凝胶组装体治疗食蟹猴腰椎间盘退变
该研究工作得到国家自然科学基金委面上项目(52073103、 52272276、51873069和52203164)以及联合基金项目(U22A20162)等经费资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202315592








