饥饿疗法通过阻断肿瘤的血液供应或剥夺其所需的营养物质,如葡萄糖和氧气,以抑制肿瘤的生长和存活。然而,饥饿疗法存在持久性差和肿瘤易发生复发和转移的固有缺点。另一方面,传统的化学治疗或者光学治疗均需要使用化疗药或者光敏剂。这些小分子毒性物质的使用过程中无法避免毒副作用的产生,对正常组织的会造成不可逆的损伤。因此,亟需开发新的肿瘤治疗方式以解决传统肿瘤治疗过程中的问题。

近期,海南大学郭东波副教授团队提出一种无需药物的互穿聚合物网络(IPN)水凝胶用于肿瘤饥饿治疗策略。利用温度响应可自由基聚合的水凝胶在凝胶化过程中收缩衍生的内应力和局部高温的热效应,对肿瘤血管的压缩和肿瘤热消融共同形成的协同效应,以实现恶性肿瘤治疗。使用N-异丙基丙烯酰胺(NIPAM)的温敏特性,优化并控制临界温度在体温范围内,使得NIPAM的氢键破坏后释放的热量,导致被硝基咪唑固定的自由基重新被激活,诱导单体聚合并引起原位热效应的产生。体温敏感水凝胶的凝胶化过程中具有58.5%的收缩率,体内实验证实这种水凝胶可显著降低血管密度、诱导肿瘤缺氧,以达到“饿死”肿瘤细胞的目的。结合水凝胶的原位热效应诱导细胞凋亡,实现高效肿瘤饥饿组合治疗。此策略为开发无化疗/光疗药的饥饿疗法提供了新思路。
如图1所示,作者构建了可注射的IPN水凝胶,其主要由两个功能组分构成:热响应性组分(“A胶”)与热疗组分(“B胶”)。通过精确调控NIPAM的比例,将A胶的临界聚合温度控制在34.3℃。A胶中NIPAM的氢键结构在高于最低临界温度时被破坏,同时释放热量。这些热量使得硝基咪唑的壳聚糖衍生物(CS-NI)中被固定的自由基激活并释放,从而实现A胶的温敏聚合。这一过程通过自由基探针和电子自旋(EPR)方法证实。进一步研究了B胶和IPN水凝胶的原位热效应。如图2所示,B胶和IPN水凝胶随着丙烯酰胺的比例增加,其最高温度分别可到达95℃和47℃。其中IPN水凝胶通过依次注射A胶和B胶形成,其自由基结合的热效应不会破坏正常组织,适合用于肿瘤原位热疗。随后,IPN水凝胶优异的力学性能,包括自愈合、粘附强度、拉伸和压缩强度,通过流变等方式得到证实(图3)。并且在体外模拟血流的实验中,A胶和IPN水凝胶在凝胶化过程中均具有高收缩率,分别达到42.5和58.5%(图4)。在细胞和细胞球水平实验中,这种IPN水凝胶均具有良好的抑制效果(图5)。最后,在动物水平上使用多普勒彩超技术,证实了IPN水凝胶在血管外发生凝胶化,压迫肿瘤周围的血管,有效阻断血液及营养供给,达到饥饿疗法的效果(图6)。结合IPN水凝胶的原位热效应,IPN水凝胶显著降低肿瘤的血管密度,诱导局部缺氧和促进肿瘤细胞凋亡,最终具有优异的肿瘤生长抑制效果。
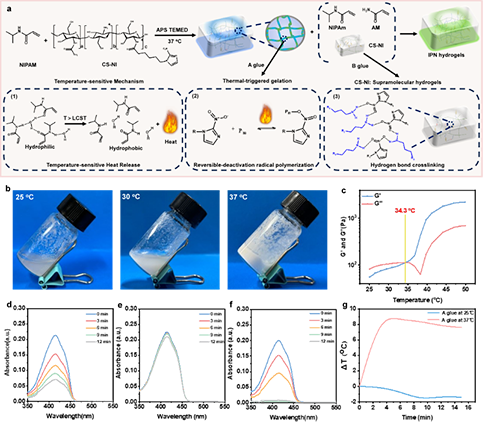
图1(a)IPN水凝胶制备示意图。NIPAM单体在LCST上产生热量的过程。在LCST上原位聚合IPN水凝胶。(b)A胶在25°C、30°C和37°C下凝胶化行为的数码照片。(c)A胶的温度依赖性流变曲线,其中凝胶化温度定义为储能模量(G′)和损耗模量(G〃′)的交点。通过测量1,3-二苯基异苯并呋喃(DPBF)峰,在25°C下自由基产生(d)CS-NI+APS+TEMED,在37°C下产生(e)CS-NI+APS+TEMED。(f)分别在25°C和25、34和37°C下APS+TEMED和CS-NI+APS+TEMED的EPR光谱。(g)将A胶的温度分别提高到25、34和37°C。

图2(a)37°C下A胶、B胶和IPN水凝胶的扫描电镜(SEM)图像。(b)温度曲线和(e)B胶的热图像(AM@NIPAM@CS-NI,0.3 mg mL-1 AM)和B''''胶(AM@CS-NI,0.3mg mL-1 AM)。(c)A胶和B胶的凝胶化时间。(d)使用了IPN水凝胶在25°C和37°C下凝胶化行为的数码照片。(f)IPN水凝胶在37°C下不同时间的温度曲线。(g)IPN水凝胶在25°C和37°C下不同时间的热图像。(h)A胶和B胶在25°C下的注射能力。A胶和B胶分别用亚甲基蓝染料和柠檬黄(柠檬黄)染料染色。
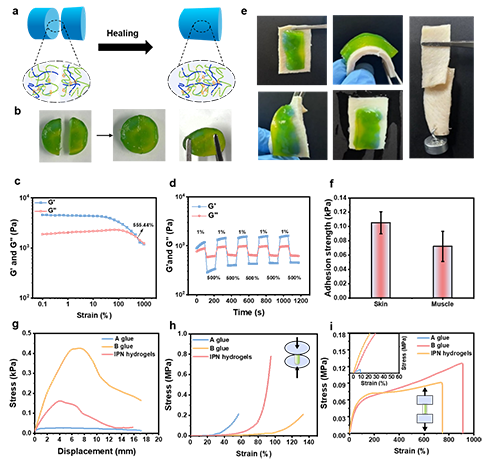
图3(a)IPN水凝胶自愈性能的示意图。(b)IPN水凝胶自愈行为的图像。在37℃下接触20分钟后,两个分离的块使完整的水凝胶愈合。(c)在37°c下将IPN水凝胶从0.1%应变扫描到1000%应变。(d)在高应变(500%)和低应变(1%)之间交替进行五轮阶跃应变循环后,IPN水凝胶流变性能的时间演变。(e)显示水凝胶对猪皮的粘附能力和机械顺应性的照片表明,水凝胶在弯曲和变形下紧紧地粘附在皮肤上。值得注意的是,即使在用水冲洗时,它也能牢固地连接在一起,没有任何脱落或断裂。(f)IPN水凝胶对皮肤和肌肉的粘附力。(g)A胶、B胶、IPN水凝胶对皮肤的粘附强度。(h)A胶、B胶、IPN水凝胶的压缩应力-应变曲线。

图4(a)利用血管外凝胶收缩引起的内应力挤压血管,估算血管(内径1.00mm)离体闭塞效应的实验过程示意图。(b)体内示意图,说明血管外凝胶收缩诱导的内应力用于血管闭塞。(c)A胶和IPN水凝胶在37°c下收缩不同分钟的照片。(d)A胶和IPN水凝胶在37°C下的收缩率。DMEM在(e)A胶和(f)IPN水凝胶凝胶聚合之前(左)和之后(右)流过小鼠脉管系统。

图5(a)L929细胞划痕试验和(b)0小时、12小时和24小时的定量分析。虚线表示初始划痕区域。(c)A胶、B胶和IPN水凝胶的L929细胞在24小时温育下的细胞存活率。(d)使用钙黄绿素AM/PI染色对A胶、B胶和IPN水凝胶对4T1细胞的活/死存活率进行测定。(e)共培养三天后,使用钙黄绿素AM(绿色)和PI(红色)对用IPN水凝胶处理的4T1细胞球体进行活/死存活率测定。

图6(a)通过收缩驱动闭塞效应和高温进行饥饿治疗的原位注射IPN水凝胶示意图。(b)SD鼠腹部动脉周围注射A胶和溶液的CDFI图像,特别是分别在注射水凝胶前后拍摄的CDFI图,其中白色箭头表示腹部动脉的血管。(c)注射IPN水凝胶的荷瘤小鼠的红外热图像。(d)分别经历G1:对照、G2:CS-NI、G3:A胶、G4:B胶、G5:IPN水凝胶的4T1荷瘤BALB/c裸鼠的肿瘤体积随时间变化(n=5)。(e)通过系统给药进行肿瘤解剖的照片。(f)治疗完成后肿瘤组织切片中HIF-1α、VEGF和CD31的免疫荧光图像。肿瘤中(g)CD31、(h)VEGF和(i)HIF-1α的定量分析。
相关成果以“Thermal-Triggered Polymerizable Hydrogels with Localized Hyperthermia for Shrinkage-Driven Starvation Therapy”为题发表在《Advanced Functional Materials》上。海南大学生物医学工程学院为文章第一单位,海南大学研究生青明为文章第一作者,郭东波副教授和陈茂华副教授为文章通讯作者。该研究得到国家自然科学基金项目(52203160, 52362006, 32360238)、三亚崖州湾科技城菁英人才项目(SKJC-JYRC-2024-34, SKJC-JYRC-2024-33)资助。
论文链接:https://doi.org/10.1002/adfm.202512839
