肿瘤异质性在癌症进展和耐药性方面起着至关重要的作用,是临床治疗癌症的一个重要挑战。由于这种异质性,大型实体肿瘤中可能包含各种各样的细胞,它们具有不同分子特征,对治疗的敏感性也各不相同。肿瘤干细胞(CSCs)或肿瘤起始细胞(TICs)是肿瘤细胞的一个亚群。它被认为是肿瘤异质性的决定因素之一,具有自我更新、高致瘤性、高侵袭性以及对各种治疗的抗性等特征。CSCs的存在已被明确地证明与多种恶性肿瘤的进展、复发和转移有关,同时也是导致肿瘤治疗失败的重要原因。还有研究表明,与分化良好的肿瘤相比,恶性程度高、预后差的分化不良肿瘤中往往CSCs表型丰度更高。因此,CSCs是癌症治疗领域的一个重要的挑战。


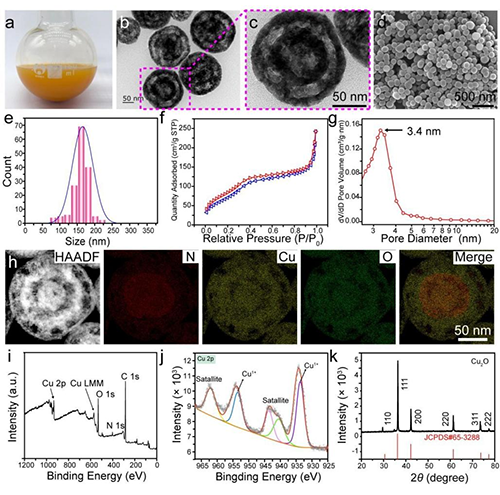
图2. CPT@ATRA@DL-HMCON@HA的制备与表征。
复合纳米药物CPT@ATRA@DL-HMCON@HA按序释放CPT和ATRA后,对选择性消除肿瘤中的CSCs和非CSCs肿瘤细胞具有协同作用。CPT@ATRA@DL-HMCON@HA被CSCs摄取后,释放外层的 ATRA。释放的 ATRA 作用于 RAR,诱导耐药性高的 CSCs 向耐药性低的非 CSCs 分化,同时导致线粒体含量和细胞内 ROS 水平增加。CPT@ATRA@DL-HMCON@HA第二次释放内层的CPT诱导了非CSCs肿瘤细胞的凋亡。DL-HMCON 本身是一种普适性药物递送系统(DDS),第三次释放的 Cu+ 触发了细胞内类芬顿反应和 GSH 消耗,从而诱导了非CSCs肿瘤细胞的铁死亡。(图1b)。

图3. DDST的细胞作用效果。

图4. CPT@ATRA@DL-HMCON@HA的体内DDST效果评价。
体内治疗结果显示CPT@ATRA@DL-HMCON@HA纳米粒能有效抑制肿瘤的生长并延长荷瘤小鼠的存活时间,展现出十分理想的肿瘤治疗效果(图4)。综上所述,该研究工作充分证明了本文作者提出的DDST策略及其构建的复合纳米药物CPT@ATRA@DL-HMCON@HA可用于肿瘤高效治疗,且对正常组织和细胞的毒性很小。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202313212
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 广西大学林宝凤教授团队 CEJ: 用于选择性控制多种害虫的生物安全性海藻酸盐基双农药控释系统 2025-06-24
- 浙江大学周民团队 Nano Today:微藻口服水凝胶协同治疗铅中毒相关疾病 2023-10-28
- 中科院上海有机所高希珂研究员与唐本忠院士团队深圳大学AIE研究中心 Angew:通过调控受体比例构筑高性能近红外二区吸收有机半导体聚合物用于高效肿瘤诊疗 2023-03-22
