蛋白质被广泛用作治疗剂和生物催化剂,用于治疗多种重大疾病和工业生产。然而,蛋白质固有的不稳定性使其在生产、制造、储存、运输和应用过程中容易受到多种环境胁迫而发生构象改变,从而导致蛋白质解折叠和聚集,这严重损害了蛋白质的稳定性和有效性,限制了其应用。这些压力包括高温、机械力、冷冻干燥、暴露于极端pH值以及有机溶剂中。因此,帮助蛋白质保持构象、阻止蛋白质聚集以及促进遭受环境压力后蛋白质的重新折叠对于保持蛋白质的生物活性至关重要。
近期,刘润辉教授课题组报道了丝绸工业中废弃的天然资源——丝胶蛋白,在多种环境胁迫下,均表现出优异的蛋白质稳定功能,这一独特优势使丝胶蛋白能够提供单一保护剂无法实现的全面保护,其保护效果远优于常用的各种蛋白质稳定剂,且突破了分子伴侣价格昂贵且不易获取的局限性,具有价格低廉、容易获得、具有优异生物相容性等优点。该研究成果以“The Cheap Silk Sericin Displaying Chaperone-like Activity to Stabilize Protein and Facilitate Protein Refolding”为题发表在CCS Chemistry上(CCS Chem. 2025, Just Published. DOI: 10.31635/ccschem.025.202505877)。
受晚期胚胎发生丰富(LEA)蛋白这一类具有高亲水性且无明确结构的特殊分子伴侣的启发,作者聚焦于丝胶蛋白,一种具有高度亲水性和高无规卷曲含量的天然蛋白质,来源于蚕丝外层,并且在丝绸工业中被大量废弃。作者研究发现丝胶蛋白具有类似分子伴侣的活性,在各种环境压力下有效地稳定蛋白质,例如高温、机械力、酸性条件、存在有机溶剂、冷冻干燥和反复冻融。此外,他们观察到丝胶蛋白还能促进蛋白质在受外界因素变性和解折叠后的再折叠(图1)。
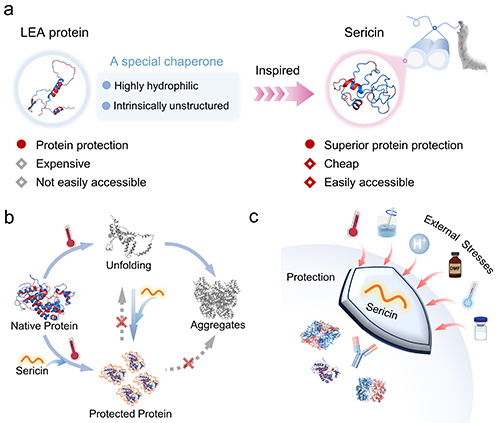
图1. 丝胶蛋白的启发来源与稳定蛋白质功能
作者先以辣根过氧化物酶(HRP,pI = 8.9)为模型蛋白,研究丝胶蛋白(SS)在高温条件下对蛋白质的保护作用。并与海藻糖和蔗糖对比。加热后,HRP活性明显降低,而随着丝胶蛋白含量的增加,HRP在热应激后的保留活性显著提高(图2)。并且显著优于常用的蛋白质分子伴侣,海藻糖和蔗糖。DLS和TEM表明丝胶蛋白可有效阻止蛋白质聚集,差式扫描荧光法表明加入丝胶蛋白后,HRP的热稳定性显著提升。此外,将HRP热变性后,再加入丝胶蛋白还可促进蛋白质的再折叠(图2)。
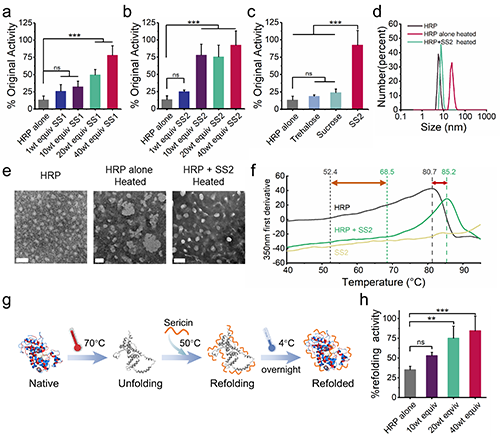
图2. 丝胶蛋白在高温下可有效稳定蛋白质
蛋白质在生产、制造、储存、运输和应用等整个生命周期中,除了高温外,还会受到酸性条件、有机溶剂、机械力和冷冻干燥等其他环境压力。这些压力会导致蛋白质变性和失活,从而降低其生物活性,因此作者使用HRP进一步探究丝胶蛋白保护蛋白质免受这些环境压力影响的能力(图3)。结果表明丝胶蛋白在酸性条件、有机溶剂、机械力和冷冻干燥这些环境压力下对蛋白质仍具有优异的稳定效果。
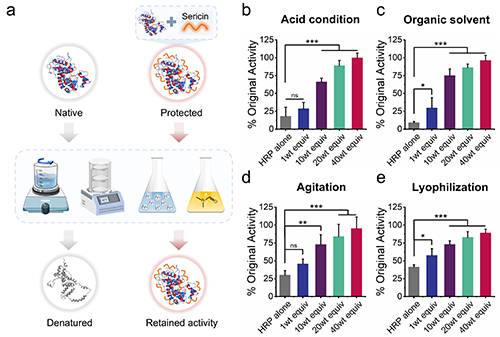
图3. 丝胶蛋白在机械力、冷冻干燥、暴露于极端pH和有机溶剂环境压力下对蛋白质具有稳定效果
为了探究丝胶蛋白稳定蛋白质功能的普适性,作者研究发现丝胶蛋白对具有不同理化性质的蛋白质(等电点从4.3到11.0)均可显著提升其热稳定性。作者进一步研究表明与HRP类似,丝胶蛋白对β-半乳糖苷酶(β-Gal,pI = 4.6)和葡萄糖氧化酶(Gox,pI = 4.6)在多种环境压力下也展现出非常优异的稳定效果。此外,研究表明丝胶蛋白还可以有效保护治疗性蛋白质如抗体免受各种环境压力的损害(图4)。
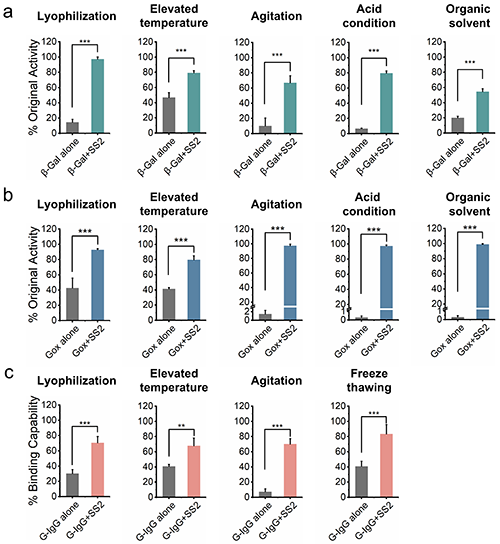
图4. 丝胶蛋白在各种环境压力下对具有不同理化性质蛋白质的稳定效果
为了探究丝胶蛋白稳定蛋白质的作用机制,PEG,一种常用的拥挤剂;和BSA,一种具有明确三级结构,且具有类似分子伴侣活性的蛋白质被用作对照。结果表明,在高温、有机溶剂和酸性条件下,PEG的保护作用非常有限甚至没有,表明在蛋白质浓度较低的情况下,排除体积效应在这些环境胁迫下起的保护作用非常有限。BSA在有机溶剂和酸性条件下有较好的保护效果,表明其能够通过与蛋白质相互作用来保护蛋白质免受环境胁迫的影响。然而,BSA自身稳定性有限导致其在高温和搅拌条件下对蛋白质几乎没有保护效果。丝胶蛋白作为一种高亲水性且无明确结构的蛋白质,在所有的这些环境胁迫下都表现出显著的保护效果(图5)。基于以上结果,作者推测丝胶主要通过与蛋白质相互作用并形成保护层来保护蛋白质免受环境胁迫。
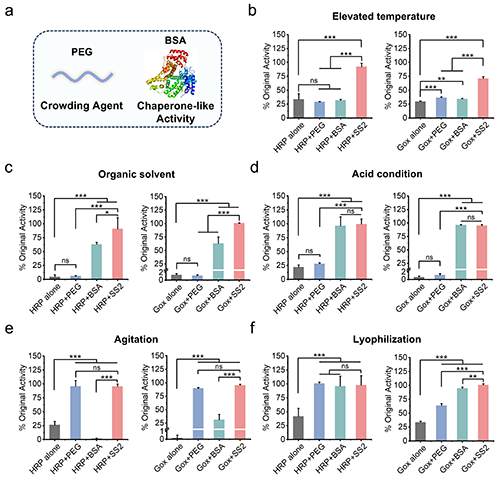
图5. 丝胶蛋白作用机制研究
作者进一步使用全原子分子动力学(MD) 模拟,通过分析丝胶蛋白与HRP之间的相互作用来验证上述猜想,结果显示丝胶蛋白链围绕在 HRP 周围形成屏障,减少了HRP的构象变化及残基波动,从而迫使蛋白质维持其初始构象。丝胶蛋白与HRP相互作用能的分析表明丝胶蛋白与HRP之间存在范德华力和静电相互作用(图6)。此外,等温滴定量热法(ITC)为丝胶蛋白与辣根过氧化物酶(HRP)的结合提供了直接证据。
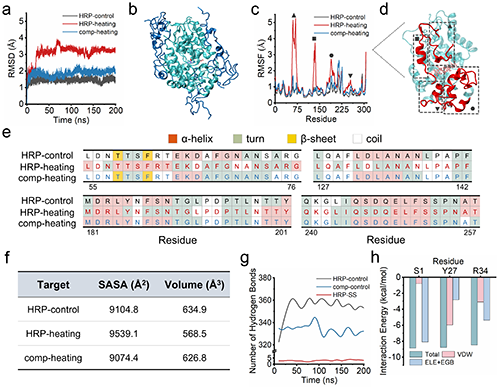
图6. 分子动力学模拟研究丝胶蛋白作用机制
蛋白质固有的不稳定性使其在各种环境胁迫下易发生去折叠和聚集,严重损害了蛋白质的稳定性和有效性,限制了其应用。丝胶蛋白突破了现有分子伴侣成本高昂、结构复杂和难以获取等问题,以及单一保护剂无法应对多重环境胁迫的局限性,同时具备价格低廉、容易获取、生物相容性好等诸多优点,在蛋白质药物保存、生物制剂开发和工业酶应用等领域展现出巨大潜力和广阔的应用前景。
华东理工大学博士生张君宇是该论文的第一作者,华东理工大学刘润辉教授是通讯作者。该研究得到了国家自然科学基金委等基金的资助。
论文链接: https://www.chinesechemsoc.org/doi/epdf/10.31635/ccschem.025.202505877
- 浙江大学毛峥伟教授课题组Adv. Mater.:一种通用的聚电解质-锁定策略:从普通蛋白质到稳定的展开蛋白基粘合剂以实现快速稳健的组织密封 2025-12-25
- UCLA贺曦敏/燕山大学秦志辉、焦体峰 Adv. Mater.: 具有优异机械性能和耐久性的完全可降解蛋白质凝胶-氢键供体的调控 2025-06-27
- 浙大毛峥伟/丁元/王伟林团队 Nat. Commun. : 新型自组装蛋白质凝胶贴片 - 快速密封大出血! 2025-02-11
- 南开史林启、天工大马飞贺《Small Methods》:Holdase/Foldase模拟纳米分子伴侣改善基于抗体的癌症免疫疗法 2022-10-19
- 南开大学史林启教授团队和中国医学科学院刘鉴峰研究员团队合作:模拟热休克蛋白介导的免疫过程增强肿瘤免疫治疗 2020-05-27
- 南开大学史林启教授、马如江副研究员团队:纳米分子伴侣调控胰岛素的递送 2020-02-25
- 郑州大学化学学院张伟教授团队招聘教师及博士后 - 高分子合成、手性高分子、超分子组装和功能高分子材料、DFT和分子动力学计算合成/组装 2026-01-12
