纳米酶因其高稳定性和可调的类酶活性,在肿瘤治疗领域展现出巨大潜力。其中,铂(Pt)基纳米酶尤为突出,它不仅兼具过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性,可用于催化治疗,还表现出优异的光热转换性能与出色的稳定性,已成为癌症治疗研究的热点。然而,肿瘤微环境(TME)的弱酸性、缺氧、高谷胱甘肽(GSH)水平及低内源性H2O2等特征,严重制约了Pt基纳米酶的催化效率及治疗效果。同时,光热治疗(PTT)诱导的热休克蛋白90(HSP90)过度表达,会增强细胞的耐热性,进而削弱光热疗效。因此,通过设计优化Pt基纳米酶的催化性能、调控肿瘤微环境以提升催化效率,并抑制热休克蛋白表达以增强光热治疗(PTT)效果,有望成为肿瘤治疗的一种有效策略。
基于此,东华大学史向阳教授/郭睿教授团队构建了一种基于 CuPt 双金属纳米酶与糖酵解抑制剂氯尼达明(Lon)协同作用的纳米治疗平台(CPL@G5-BS),旨在通过调控 TME 实现增强的光热治疗(PTT)与催化治疗(图1)。研究团队首先在部分乙酰化的第 5 代 PAMAM 树状大分子(G5)表面修饰碳酸酐酶 IX(CA IX)抑制剂——对羧基苯磺酰胺(BS),构建了载体 G5-BS。CA IX 作为一种在肿瘤细胞表面过度表达的膜蛋白,在肿瘤增殖和侵袭中起关键作用,是极具潜力的治疗靶点。BS 修饰的载体 G5-BS 能够被 CA IX 过表达的 4T1 肿瘤细胞高效摄取,并通过调控肿瘤细胞的pH“内降外升”来增强催化治疗效果,同时抑制肿瘤转移。随后,通过在树状大分子 G5-BS 内部原位还原 K2PtCl4 和 CuCl2·2H2O 负载 CuPt 纳米酶,并物理包封 Lon,最终制备得到纳米平台 CPL@G5-BS。构建 CuPt 双金属纳米酶不仅可以显著增强·OH 的生成并消耗 GSH,从而进一步提升化学动力疗法(CDT)的疗效,还能够进一步提高纳米颗粒的光热转换效率、增强光热治疗效果。与此同时,负载的 Lon 能够通过抑制 HSP90 的表达显著增强光热治疗效果,并通过减少肿瘤细胞的氧气消耗,与纳米酶的类过氧化氢酶(CAT)活性协同作用,共同缓解肿瘤乏氧。因此,CPL@G5-BS 纳米平台能够通过调控 TME 实现增强的光热/催化联合治疗,为开发新型癌症治疗策略提供了一个有前景的平台。
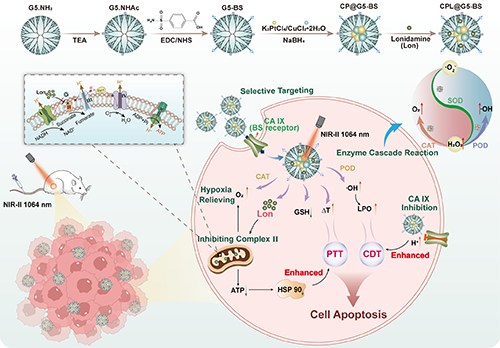
图1. CPL@G5-BS用于肿瘤微环境调控光热/催化疗法的机制示意图。
1H NMR和UV-vis证明了杂化纳米平台的成功合成(图2a-b)。TEM结果显示纳米酶呈现均匀球形,平均粒径为1.45 nm(图2c-d)。XPS图谱显示Pt和Cu以多种价态共存(图2e-f)。药物释放曲线显示Lon在pH 5.5时释放量更高,说明其具有pH响应性(图2g)。最终材料的水合粒径在7天内没有明显变化,证明其具有良好的胶体稳定性(图2h)。此外,CPL@G5-BS具有良好的血液相容性,表明其具有安全生物医学应用的潜力,能够用于后续的体内实验(图2i)。
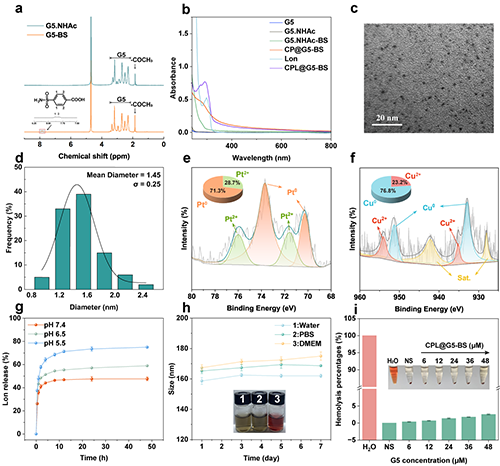
图2.(a)G5.NHAc和G5.NHAc-BS的1H NMR谱图。(b)G5、G5.NHAc、G5.NHAc-BS、CP@G5-BS、Lon及CPL@G5-BS的UV-Vis吸收光谱。(c)CPL@G5-BS的TEM图像及(d)对应的尺寸分布直方图。CPL@G5-BS的(e)Pt 4f和(f)Cu 2p高分辨率XPS谱图。(g) 不同pH条件下Lon的释放行为。(h) CPL@G5-BS分散于不同介质中7天后的水合粒径变化。(i) 用Water、PBS及CPL@G5-BS([G5] = 6、12、24、36、48 μM)处理后的红细胞溶血率和图像。
团队系统研究了CPL@G5-BS 的光热性能及酶催化特性。光热研究结果显示在激光照射下,CPL@G5-BS溶液温度与浓度呈正相关且具有高光热稳定性(图3a-b)。此外, Cu 掺杂可以增强其光热性能(图3c)。团队进一步探究了Cu掺杂及光热效应对CPL@G5-BS类酶活性的影响。CPL@G5-BS的类SOD酶活性超过PL@G5-BS,且在激光照射下进一步增强(图3d)。TMB氧化反应证实了CPL@G5-BS的POD酶活性(图3e)。在激光照射下,POD酶活性因温度升高而增强(图3f)。在弱酸性条件下其具有最强的POD酶活性(图3g)。催化动力学结果进一步证明了其优异的类POD酶活性(图3h-i)。除此之外,CPL@G5-BS还表现出优异的类CAT酶活性(图3j-k)。总之,CPL@G5-BS在铜掺杂和激光照射下表现出优异的光热性能、类SOD、POD和CAT酶活性。能够在肿瘤部位持续产生ROS和O2,说明CPL@G5-BS在癌症治疗方面的巨大潜力(图3l)。
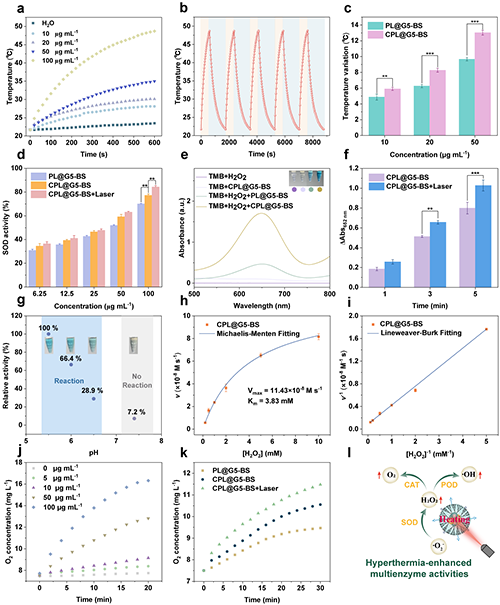
图3.(a)不同浓度CPL@G5-BS溶液在1064 nm激光(0.6 W·cm-2)照射10分钟下的温度变化。(b)CPL@G5-BS溶液([Pt] = 100 μg·mL-1)在1064 nm激光(0.6 W·cm-2)下的循环加热曲线。(c)PL@G5-BS与CPL@G5-BS在不同浓度下的温度变化对比。(d)不同处理组的SOD酶活性。(e)pH 5.5条件下,不同溶液反应15分钟后的吸光光谱及溶液颜色变化。(f)CPL@G5-BS在有无激光照射下652 nm处的紫外吸收强度对比。(g)pH对CPL@G5-BS类 POD酶活性的影响。(h)CPL@G5-BS的米氏动力学曲线及(i)Lineweaver-Burk双倒数图。(j)pH 6.5条件下,CPL@G5-BS与H2O2共存条件下的O2生成量。(k)不同处理组的类CAT酶活性([Pt] = 20 μg·mL-1)。(l)CPL@G5-BS光热增强多酶活性的机制示意图。
研究团队选用4T1细胞进行体外实验评价。细胞毒性实验显示CPL@G5-BS+Laser组对4T1细胞具有最佳的杀伤效果(图4a-b)。细胞吞噬验证BS介导的靶向作用促进了对材料的摄取(图4c-f)。pH检测结果显示BS能够有效抑制CA IX的活性,从而诱导细胞内pH降低、提升催化效率,并减少细胞外基质酸性、抑制肿瘤细胞转移(图4g-h)。
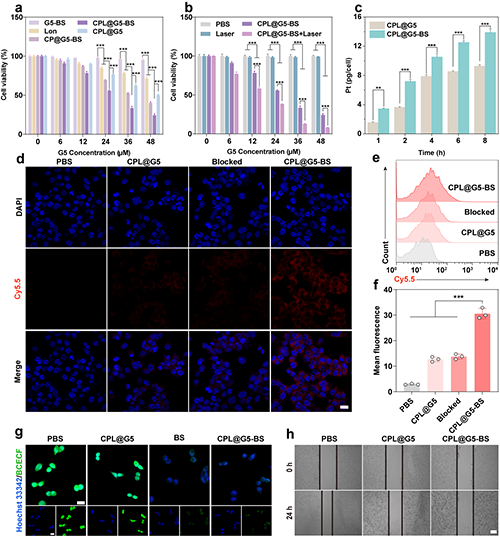
图4.(a)不同材料对4T1细胞的细胞毒性评估。(b)不同处理对4T1细胞的细胞毒性评估。(c)4T1细胞与不同材料孵育后细胞内的Pt含量。(d)4T1细胞与PBS、GPL@G5、Blocked-CPL@G5-BS和CPL@G5-BS复合物孵育6小时后的CLSM图像(GPL@G5和CPL@G5-BS用Cy5.5标记)。(e)流式细胞术检测不同条件培养后4T1细胞中Cy5.5的滞留情况和(f)平均荧光强度。 (g) 不同处理4小时后BCECF染色的4T1细胞CLSM图像。(h)不同处理条件下4T1细胞迁移的划痕实验图像。在(d)和(g)中,标尺 = 20 μm。在(h)中, 标尺 = 500 nm。
随后,研究团队探究了CPL@G5-BS的体外抗肿瘤机制。CPL@G5-BS+Laser组诱导了最显著的ROS产生、GSH耗竭和LPO积累(图5a-d)。由于活性氧的积累会导致氧化应激和线粒体损伤的恶性循环,研究团队采用JC-1评估了线粒体膜电位。CPL@G5-BS组几乎没有红色荧光,表明催化治疗和PTT的组合加剧了线粒体损伤(图5e)。
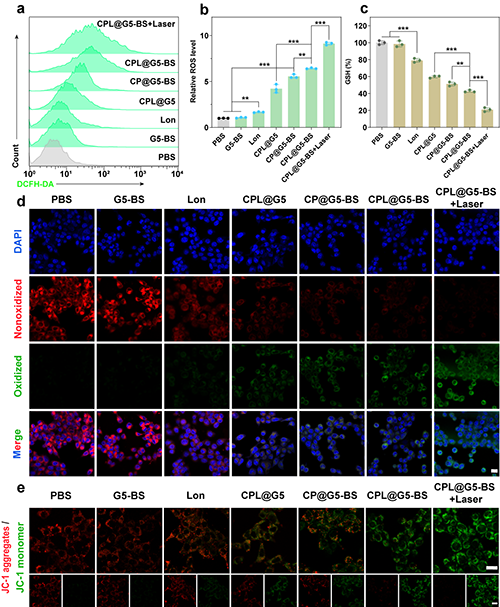
图5.(a)流式细胞仪分析 4T1 细胞经不同处理 4 小时后的细胞内 ROS 水平和(b)定量分析。(c)不同处理4小时后4T1细胞内GSH的相对水平。(d)通过CLSM观察不同处理4 h后4T1细胞中LPO的表达水平。(e)4T1细胞经不同处理后的JC-1染色。在(d)和(e)中,标尺 = 20 μm。
团队进一步评估了Lon对于肿瘤细胞能量代谢的抑制作用。CPL@G5-BS+Laser组肿瘤细胞缺氧得到明显缓解(图6a),ATP水平显著下降(图6b),HSP90表达显著降低(图6c-d)。此外,活/死染实验证实了CPL@G5-BS在激光照射下对4T1细胞的有效消融。CPL@G5-BS+Laser表现出最高水平的细胞死亡,证实了PTT和催化治疗的协同效应(图6e)。图6f阐明了CPL@G5-BS的体外抗肿瘤机制。在其被4T1细胞特异性摄取后,可通过多酶活性显著促进ROS生成、消耗GSH、缓解肿瘤缺氧。同时,Lon可以抑制O2消耗、降低ATP水平、抑制HSP90的表达,从而克服癌细胞的耐热性。在激光照射下,CPL@G5-BS表现出优异的PTT性能和增强的CDT,从而获得优异的治疗效果。
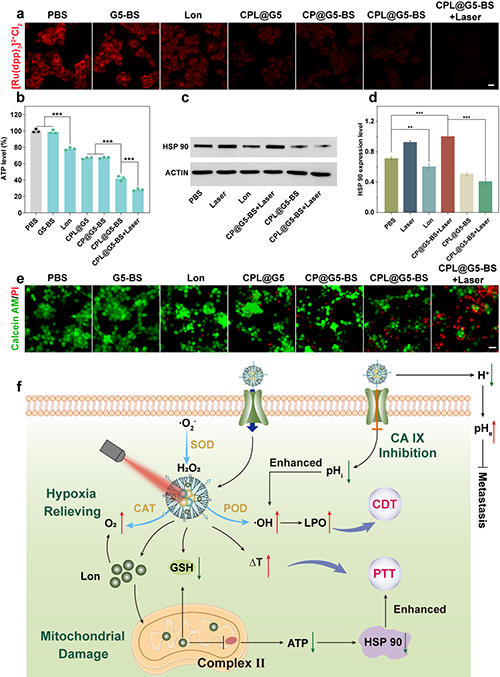
图6.(a)使用[Ru(dpp)3]2+Cl2探针检测不同处理后4T1细胞中的O2含量,标尺 = 20 μm。(b)不同处理4小时后4T1细胞内ATP的相对水平。HSP90表达水平的(c)WB分析和(d)定量结果。(e)不同处理后4T1细胞的Calcein-AM/PI双染色图像,标尺 = 50 μm。(f)CPL@G5-BS的抗肿瘤机制。
研究团队构建了4T1荷瘤小鼠模型,按图7a所示时间线进行了体内抗肿瘤实验评价。光热成像显示CPL@G5-BS治疗组肿瘤部位温度明显高于对照组(图7b)。治疗结束后各组小鼠的体重均略有增加,表明材料均没有明显的毒性(图7c)。且CPL@G5-BS+Laser治疗组的肿瘤体积最小、重量最轻,说明其具有最佳的肿瘤抑制效果(图7d-f)。CPL@G5-BS+Laser组小鼠肺转移结节明显减少,几乎接近健康状态,表明CPL@G5-BS具有显著的抑制肿瘤转移的能力(图7g-h)。

图7.(a)静脉注射CPL@G5-BS治疗4T1荷瘤小鼠的示意图。(b)4T1 荷瘤小鼠在 1064 nm 激光照射(0.6 W cm-2)下接受不同治疗后的红外热成像:Ⅰ)PBS、Ⅱ)CPL@G5、Ⅲ)CPL@G5-BS。不同治疗后(c)小鼠体重和(d)相对肿瘤体积的变化。(e)各组切除肿瘤的照片和(f)重量:1)PBS、2)Lon、3)CPL@G5、4)CP@G5-BS、5)CPL@G5-BS、6)CPL@G5-BS + Laser(n = 6)(g)不同处理后第 14 天 4T1 荷瘤小鼠的代表性肺组织照片以及(h)相应的 H&E 染色(标尺 = 1 mm)。
为了比较分析不同治疗组之间的肿瘤抑制效果,研究团队对肿瘤组织切片进行了H&E、TUNEL和Ki67 染色(图 8a)。结果证明CPL@G5-BS+ Laser 组显示出最显著的肿瘤细胞坏死、凋亡,以及最大的肿瘤细胞增殖抑制。免疫荧光染色结果显示CPL@G5-BS+Laser处理的肿瘤中观察到了最显著的CA IX抑制、HIF-1α下调和HSP90抑制(图8b)。
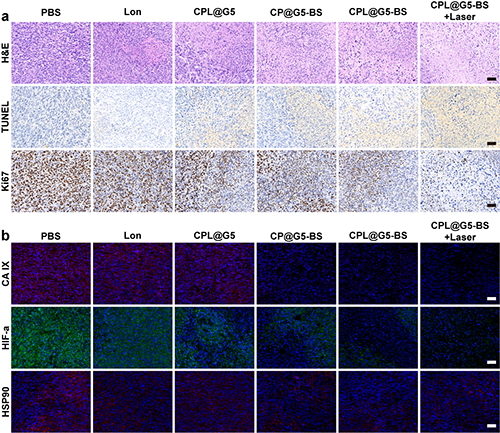
图8.(a)各组肿瘤组织的 H&E、TUNEL 和 Ki67 染色。(b)不同处理后肿瘤切片的 CA IX、HIF-α、HSP90 染色。在(a)和(b)中,标尺 = 50 μm。
简而言之,团队所构建的CPL@G5-BS具有以下特点:1)在 Cu 掺杂和近红外二区激光照射的共同作用下,CPL@G5-BS展现出增强的级联催化活性;2)BS修饰使 CPL@G5-BS 在 4T1 肿瘤部位蓄积,并通过抑制 CA IX 活性实现了肿瘤细胞内、外 pH 逆转,增强了催化治疗效果并有效抑制肿瘤转移;3)Lon通过破坏肿瘤细胞能量代谢、下调 HSP90,克服了 PTT中的热抵抗效应,同时减少 O2消耗缓解肿瘤乏氧TME。通过调控TME,这种多模式策略不仅促进了激光照射下的有效PTT效果,而且增强了级联催化治疗,从而发挥了显著的肿瘤抑制作用、抑制肿瘤转移。
以上研究成果以“Dendrimer-Entrapped CuPt Bimetallic Nanozyme for Tumor Microenvironment Regulated Photothermal/Catalytic Therapy”为题,在线发表于国际著名期刊ACS Applied Materials & Interfaces (DOI: 10.1021/acsami.5c05324)。东华大学生物与医学工程学院郭睿教授与史向阳教授为共同通讯作者,东华大学硕士研究生卢世转为第一作者。该工作得到了国家自然科学基金、上海市科学技术委员会等的资助。
论文信息:
Shizhuan Lu, Aiyu Li, Haoyu Huang, Cheng Ni, Xueyan Cao, Xiangyang Shi*, Rui Guo*. Dendrimer-Entrapped CuPt Bimetallic Nanozymes for Tumor Microenvironment-Regulated Photothermal/Catalytic Therapy. ACS Appl Mater Interfaces, 2025, 17: 30716-30730.
文章链接:https://doi.org/10.1021/acsami.5c05324
