混合细菌感染,尤其是革兰氏阳性菌(G+)与革兰氏阴性菌(G-)共同引发的感染,是创伤护理领域的一大挑战,其重要原因是传统单一抗生素疗法难以同时对两类细菌发挥杀菌作用,而二联疗法存在给药方案复杂、难以在时空上有效协同和耐药等问题。针对上述问题,北京化工大学王兴教授团队开发了一种pH响应型无载体纳米药物(PBN)。该药物通过动态席夫碱键合策略,将多粘菌素B(PMB,清除G-)与对醛基苯甲酸龙脑酯(BF,清除G+)自组装成纳米颗粒,以此实现对混合感染的高效治疗(图1)。研究显示PBN能借助静电相互作用吸附在细菌表面,从而提高局部治疗剂的浓度;在感染部位的酸性微环境触发下,PBN会通过席夫碱键的断裂特异性释放PMB和BF,分别靶向杀灭多重耐药铜绿假单胞菌(MDR-PA,G-)和多重耐药金黄色葡萄球菌(MDR-SA,G+)。与PMB/BF的双药联合给药相比,凭借自组装形成的纳米结构,PBN在对抗细菌混合感染时表现出更高的疗效,同时还显著增强了抗生素清除混合细菌的效果,成功实现了对小鼠混合细菌感染伤口的有效治疗,在混合细菌感染治疗中显示出良好的应用潜力。

图1.PBN清除混合细菌(MDR-SA/PA)促进伤口愈合的示意图。
文章要点:
(1)PBN协同高效清除MDR-SA/PA混合细菌:PBN对MDR(SA/PA)的最小抑菌浓度约4μg/mL,相对于PMB/BF降低了4倍,并且最小杀菌浓度结果显示PBN在浓度为10μg/mL时可清除所有混合细菌,这比PMB/BF的杀菌效果提高了2倍。此外,生长曲线结果显示,在浓度降低至8或4μg/mL时,只有PBN保持了显著的抗菌效果,而PMB/BF未能抑制多重耐药菌(SA/PA)的生长,表明PBN在较低浓度下能更有效地抑制G+/G-细菌菌株的生长(图2)。
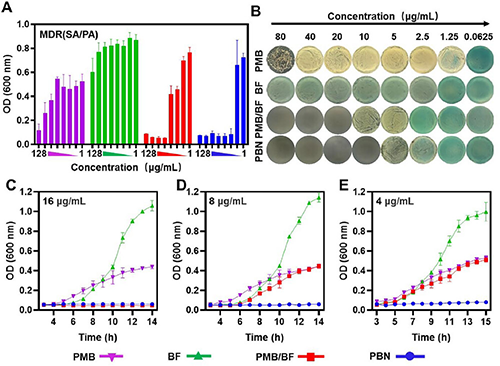
图2.PBN对混合细菌(多重耐药金黄色葡萄球菌和多重耐药铜绿假单胞菌)的清除效果。
(2)PBN有效破坏G+和G-细胞壁和细胞膜: PBN处理显著提高了MDR-SA和MDR-PA的膜电位,导致细菌膜去极化;同时出现了严重的壁膜皱缩和受损。蛋白泄漏结果显示,PBN组的蛋白质泄漏量显著高于对照组,表明PBN处理导致细胞壁和细胞膜的严重破坏、细胞内物质的泄漏增加,最终导致细菌死亡(图3)。
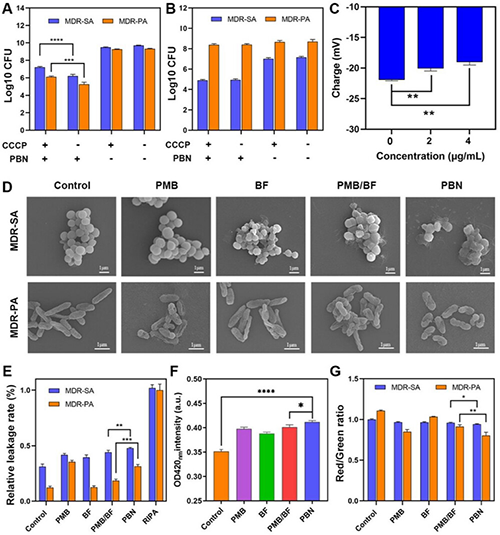
图3.PBN清除多MDR-SA和MDR-PA的机制研究。
(3)PBN精准清除体内混菌感染及促进伤口愈合:利用小鼠皮肤伤口混合感染(MDR-SA/PA)模型,治疗研究显示单药处理和PMB/BF混合处理对伤口混合细菌的清除作用非常有限(>102 CFU),而PBN组表现出最低的细菌残留、最快的伤口闭合速度(<102 CFU)以及在恢复期加速的体重增长,明显优于其他组(图4)。
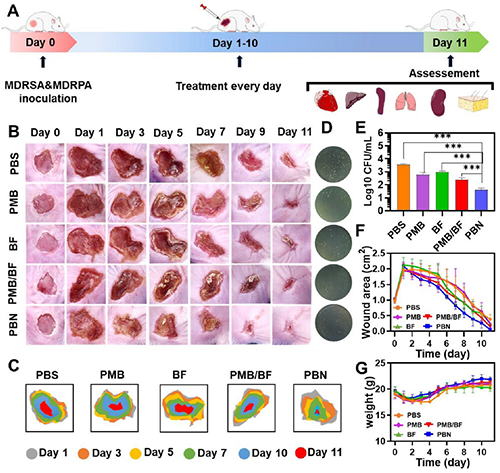
图4.PBN对体内伤口混合细菌感染的治疗效果评价。
综上所述,该研究报道了一种用于消除细菌混合感染并加速伤口愈合的新型无载体纳米粒子PBN。与PMB/BF的双药联合给药相比,PBN由于其自组装的纳米结构,在对抗细菌混合感染方面表现出更高的疗效,最终加速伤口愈合。
此外,针对G+和G-混菌感染,无载体策略是同步施用双抗生素的最优解,在保障有效性的同时做到成分的全利用,提高药物生物利用度,减少药物剂量的同时提升了治疗疗效(“减量增效”)。因此,本研究为创伤护理中治疗细菌混合感染提供了一种全新的给药新策略。
相关研究成果以“DualAntibiotics-BasedpH-ResponsiveCarrier-FreeNanodrugagainstBacterialMixedInfectionforAcceleratedWoundHealing”为标题发表在学术期刊AdvancedHealthcareMaterials上。本论文第一作者为北京化工大学生命科学与技术学院研究生杨佳丽和张晓雨,通讯作者为北京化工大学王兴教授、李国锋副教授和谢文升副教授。该研究得到国家自然科学基金等项目的资助与支持。
课题组网站:http://www.wangxing-lab.com/team.aspx?pid=2510
文章链接:https://doi.org/10.1002/adhm.202501845
