尽管ROS响应性智能药物递送系统近年来发展迅速,但由于肿瘤细胞内ROS的浓度相对较低(虽然比正常组织细胞内ROS浓度高),往往不足以快速有效地刺激药物递送系统释放活性药物。因此肿瘤细胞内较低的ROS浓度已成为ROS响应智能给药系统进一步发展的瓶颈。

图1 负载β-拉帕醌和氮芥前药纳米粒子的制备及其在肿瘤细胞内前药的顺次诱导激活
该工作旨在选择性地增加肿瘤细胞中的H2O2水平,从而为ROS响应性药物控释系统提供药物释放条件。如图1所示,兰州大学赵光辉副教授课题组与兰州大学基础医学院程菊老师合作,研发了一种新型的ROS响应药物释放平台,它可以有效地同时递送ROS响应性氮芥前药和产生ROS的β-拉帕醌。首先设计并合成了两个两嵌段分子(mPEG-AcMH和PAsp-AcMH),用以构建“顺次诱导激活”释药体系。选择生物相容好且富含官能团的天然化合物麦芽七糖作为骨架分子,麦芽七糖分子通过缩醛化反应使其形成作为疏水链段的AcMH;PAsp是聚氨基酸链段,其具有带负电荷的侧链以静电吸附氮芥前药作为亲水链段。上述两个分子通过Click反应连接形成两亲性嵌段聚合物PAsp-AcMH。为了使药物载体有更好的生物相容性,制备了另一种两嵌段分子mPEG-AcMH。最后两种两嵌段分子、带正电荷的氮芥前药和β-拉帕醌自组装形成初级胶束,其进一步聚集形成药物共递送的纳米颗粒。静脉注射使其进入动物血液循环系统后,纳米颗粒通过EPR效应到达肿瘤部位并通过胞吞作用进入肿瘤细胞。肿瘤细胞中溶酶体内的弱酸环境使缩醛键断裂,导致纳米颗粒解体并释放出ROS响应的氮芥前药和β-拉帕醌。在肿瘤细胞中释放的β-拉帕醌在醌氧化还原酶1(NQO1)的作用下诱导产生大量的ROS(图2),进而在ROS的诱导下氮芥前药被活化,生成抗肿瘤药物氮芥,活化的氮芥进一步诱导肿瘤细胞凋亡(图3)。简而意之,所设计前药胶束在肿瘤细胞内的“顺次诱导”过程为:前药胶束进入肿瘤细胞 → 肿瘤细胞内的弱酸环境 → 诱导β-拉帕醌释放 → β-拉帕醌诱导肿瘤细胞内产生大量ROS → ROS诱导激活抗肿瘤药物 → 肿瘤细胞凋亡。通过该工作的研究,可为进一步研究开发新型的ROS响应性药物控释系统提供理论基础,为传统方式无法实现的非稳定性药物输送提供新思路。
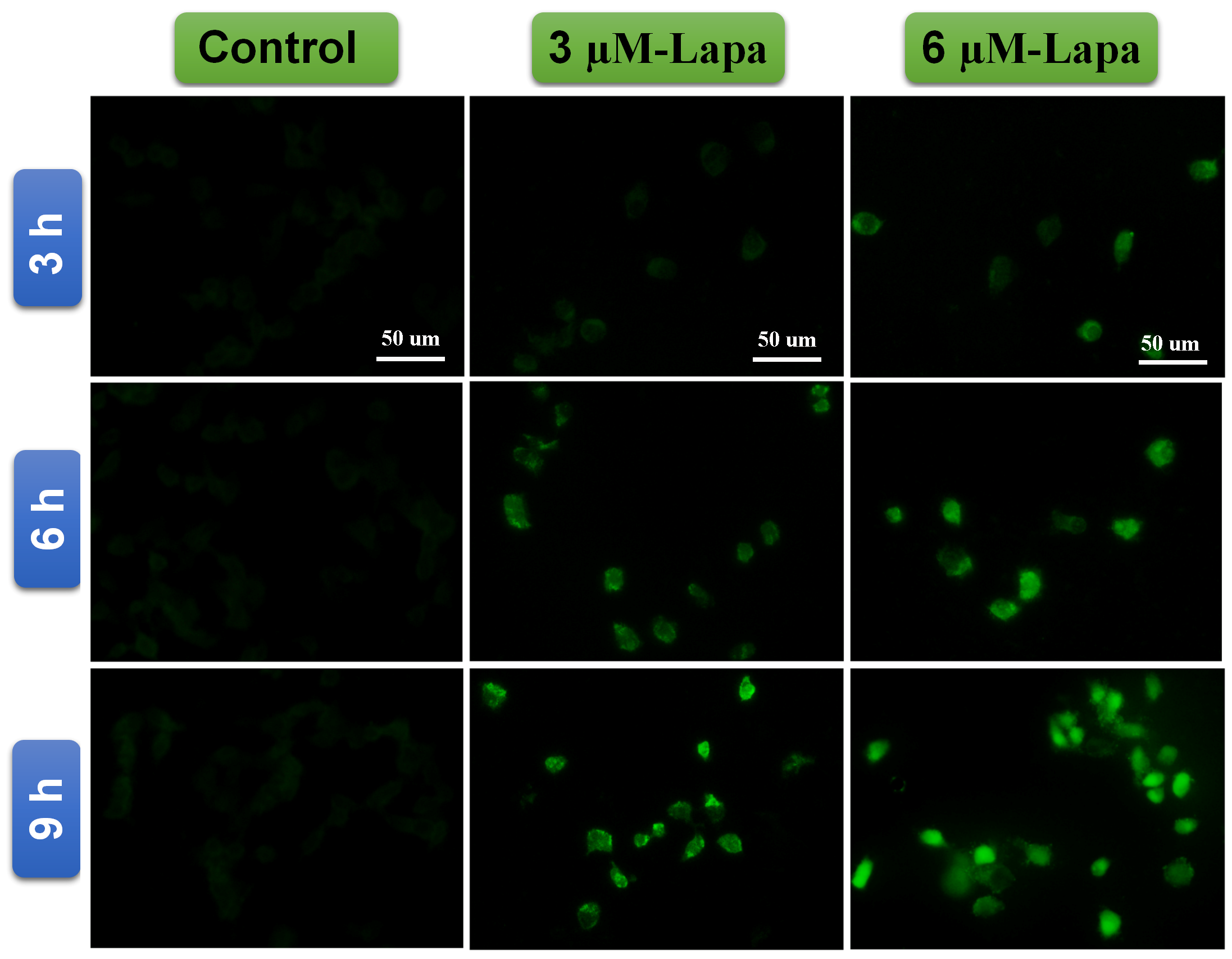
图2 β-拉帕醌诱导Hela细胞产生ROS的荧光显微照片

图3 (A)不同浓度P-Lapa对Hela,A-549,MCF-7和L929细胞的细胞毒性;(B)β-拉帕醌与不同浓度氮芥联合使用对Hela细胞的细胞毒性;(C)对A-549细胞的细胞毒性;(D)对MCF-7细胞的细胞毒性
以上研究内容以“Tailored Design of an ROS-Responsive Drug Release Platform for Enhanced Tumor Therapy via “Sequential Induced Activation Processes””为题发表在《ACS Applied Materials & Interfaces》上。2016级硕士栾婷婷、2015级硕士程路路、兰州大学基础医学程菊老师为本论文的共同第一作者,兰州大学赵光辉副教授为论文通讯作者。该课题得到了国家自然科学基金委(Nos. 21772080)、中央高校基本科研业务费(lzujbky-2019-kb06)等项目的资助。
兰州大学赵光辉副教授团队长期致力于生物医用高分子和纳米材料的设计合成,围绕创伤修复和肿瘤的诊断治疗,重点开展软组织的创伤修复材料、止血材料以及药物输送研究。研究成果相继刊发在Polym. Chem., 2018, 9, 1337–1347; Chem. Commun., 2017, 53, 12302–12305; Chem. Asian J. 2017, 12, 176–180等期刊上,为相关领域的发展提供了理论和技术指导。
- 北化樊保民/赵景茂《Corros. Sci.》:MXene赋能新交联机理构建强耐热漆酚防护涂层 2025-06-18
- 西南医大口腔医院陶刚/黎春晖/蔡蕊团队:具有ROS触发药物释放特性的可注射水凝胶实现抗菌剂和抗炎纳米颗粒协同递送用于牙周炎治疗 2025-04-15
- 华南理工唐本忠院士团队冯光雪教授/南开丁丹教授 ACS Nano:双模态ROS刺激的一氧化碳释放用于光动力和气体肿瘤的协同治疗 2024-11-05
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 武汉理工大学戴红莲教授课题组 AFM:诱捕细菌联合磁热协同杀菌的智能给药系统高效修复感染性骨缺损 2023-04-02
