基于微流控液滴的单细胞测序方法因其极高的通量和单细胞的灵敏度而引发了生物学的一次革命。在微流控单细胞测序技术中,DNA编码微球是其核心。目前常见的用于高通量单细胞测序的DNA编码微球分别为在inDrop技术、Drop-seq技术和10X Genomics公司测序技术中使用的微球。这些微球各有其优缺点:inDrop技术中的条形码微球由于能够紧密堆积从而能够在液滴中高效负载,但其合成所需的引物价格昂贵且需要引入对细胞和核酸有影响的紫外光;Drop-seq技术中的条形码微球因反应过程集中在微球表面而降低总体反应效率;10X Genomics公司测序技术中的DNA编码微球价格昂贵且DNA编码引物不能灵活调节。因此,如何发展一种新的易制备、易操作、造价低、效率高的DNA编码微球是高通量单细胞测序技术开发中的一个难题。
David Weitz教授课题组报道了一种可控降解的聚丙烯酰胺条形码微球的制备方法。该微球能够在DTT(二硫苏糖醇,一种与多数生物化学体系兼容的常见的还原剂)存在下快速发生降解,并将微球上的DNA释放到液滴中。该可控降解型聚丙烯酰胺凝胶条形码微球容易制备、容易降解、制作成本低、反应效率高、条形码设计灵活且能够在液滴包裹中实现紧密堆积而提高液滴使用率。
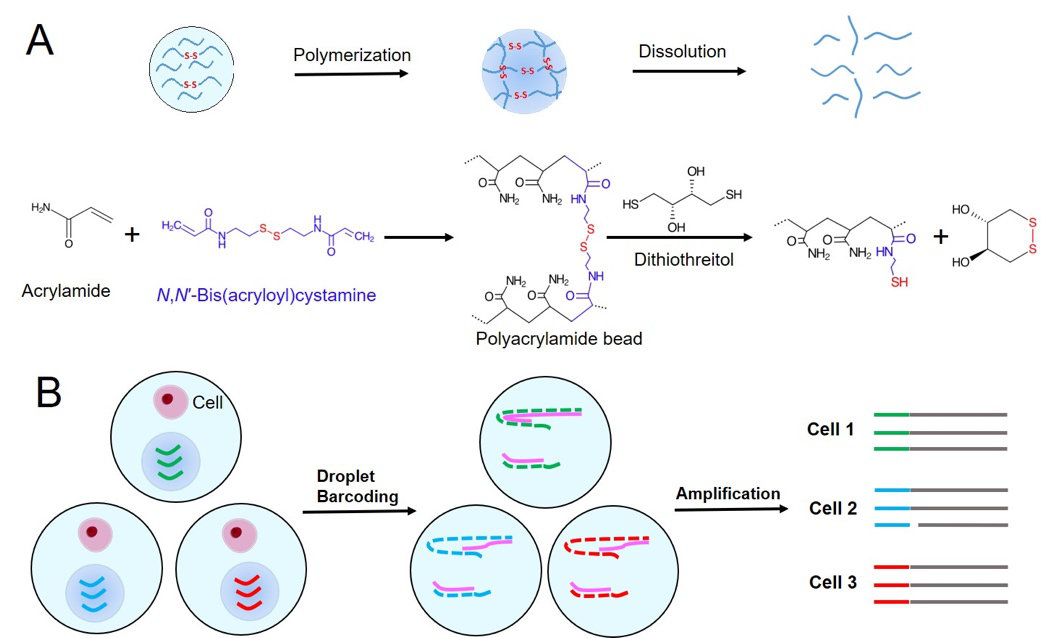
图1. (A) 可控降解型聚丙烯酰胺微球的合成和降解原理示意图,(B)可控降解型微球在基于液滴的单细胞分析过程使用的图示。
该团队使用微流控设备首先制备了该可降解型聚丙烯酰胺凝胶微球,并探究了在DTT存在下的降解情况。实验证明直径为80 μm左右的微球在1 mM DTT存在下能够在3 min中完全降解,在10 mM DTT存在下能够在30 s内完全降解。聚丙烯酰胺凝胶微球降解后能够将微球上的引物释放到溶液中使其有效地进行后续的逆转录及PCR反应,同时,降解后的产物并不会引起溶液物理性质,如粘度等的变化。
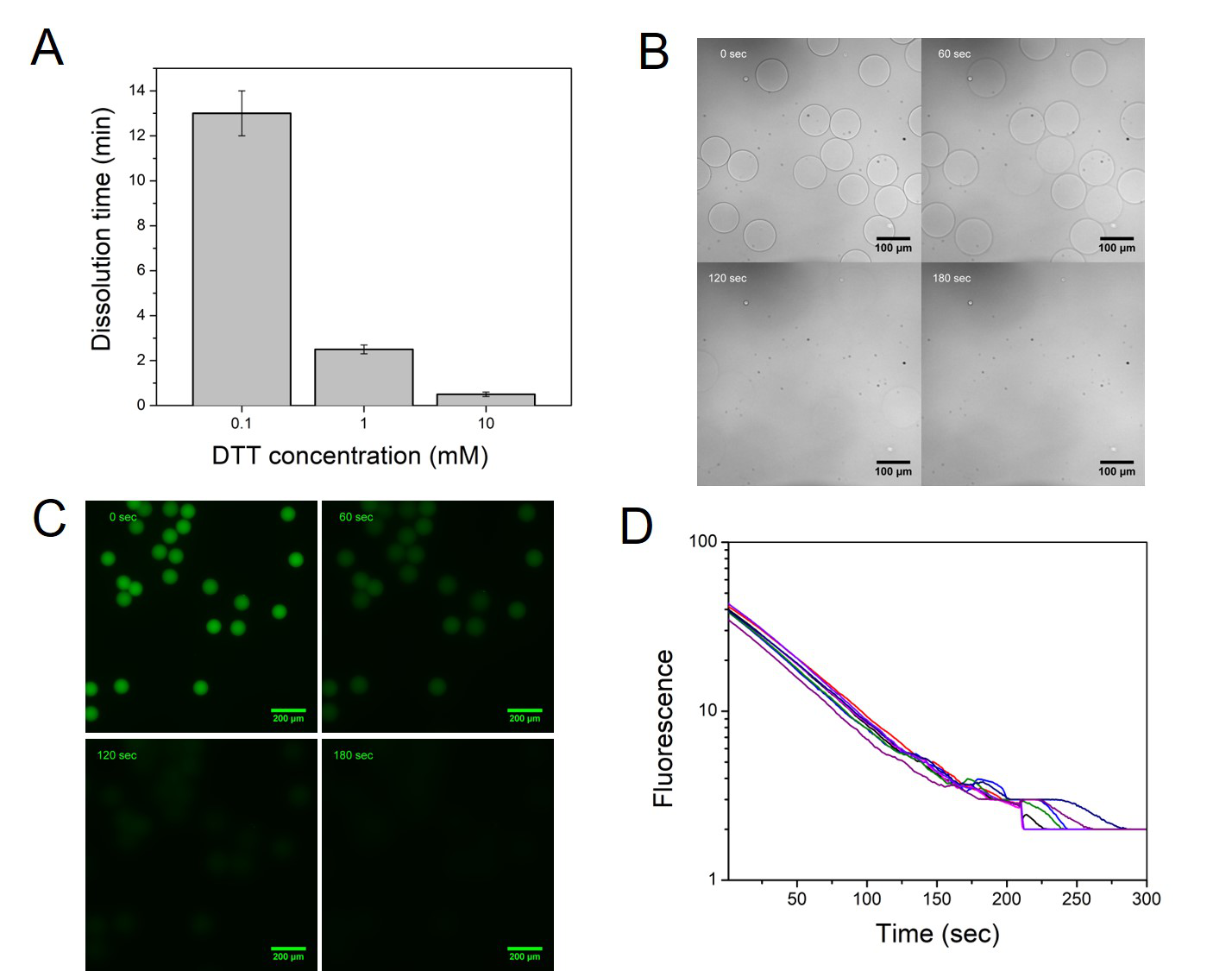
图2. (A) 微球在不同DTT浓度下的降解时间,(B)在1 mM DTT存在下0, 60, 120,以及180 s时微球在显微镜下的状态,(C)在1 mM DTT存在下0, 60, 120,以及180 s时标记上荧光后的微球的荧光图像,(D)随机选择8个微球的荧光强度在降解过程中随时间的变化情况。
在此基础上,该团队将可控降解型聚丙烯酰胺凝胶微球用于高通量液滴中单细胞的RNA和蛋白表达分析中。首先,将单个细胞和单个标记上目标基因引物序列的可降解型聚丙烯酰胺凝胶通过微流控技术包裹在单个液滴中,微球在DTT存在下降解后,将引物释放到液滴里,去捕获细胞裂解后的mRNA。以GAPDH和TCRA的mRNA为例,实验结果证明,该方法能够有效的捕获细胞中的目标mRNA,如下图3所示。同时,若将编码DNA和细胞表面蛋白的抗体偶联并预先与细胞温育,则该可降解型聚丙烯酰胺凝胶微球还可以应用在单细胞的细胞表面蛋白,如CD3的表达分析中。在单细胞的RNA测序和蛋白表达分析中,可降解型聚丙烯酰胺凝胶微球不会对后续的生物化学反应造成影响,能够有效地实现其条形码引物释放的功能,并呈现出独特的功能优势。同时,可降解型聚丙烯酰胺凝胶微球作为新的高通量单细胞测序分析中使用的工具,改善了传统的条形码微球的制备方案,能够有效促进高通量单细胞测序技术的进一步发展。

图3. (A)显微镜下包裹单个细胞和单个微球的液滴的产生过程,(B) TCRA和GAPDH mRNA的qPCR实验结果,(C) GAPDH和TCRA mRNA在液滴中反应后PCR产物的琼脂糖凝胶电泳实验结果,(D)抗体–DNA偶联物结合细胞表面蛋白的示意图,(E)单细胞表面蛋白分析中的qPCR实验结果,(F)细胞表面蛋白分析中的琼脂糖凝胶电泳实验结果。
以上相关实验成果发表在Advanced Science杂志上(Adv. Sci. 2020, 1903463)。论文的第一作者兼通讯作者为哈佛大学博士生Yongcheng Wang,共同第一作者为北京大学博士生Ting Cao,共同通讯作者为哈佛医学院的Ralph Weissleder教授和哈佛工学院的David Weitz教授。
论文链接:https://onlinelibrary.wiley.com/doi/pdf/10.1002/advs.201903463
- 国立京都工艺纤维大学徐淮中团队 AFM:高精度3D打印制备可降解医疗器械 2026-01-04
- 深圳大学黄龙彪教授团队 《Adv. Sci.》综述:生物可降解材料在软体机器人与柔性电子领域的研究进展 2025-09-10
- 大连理工大学刘野教授 Angew:可降解新型聚酮弹性体合成 - 助力可持续材料开发 2025-08-30
- 四川大学吴锦荣教授团队 Nat. Commun.:可解缠的瞬态缠结 - 实现聚丙烯酰胺水凝胶的强韧化 2026-03-07
- 宁波材料所王荣/上海大学尹静波/宁波大学附属第一医院沈毅 Adv. Mater.:植酸诱导模量梯度离子导电水凝胶压力传感器 2025-01-20
- 天津工业大学王润、刘雍/南开大学刘遵峰《Adv. Sci.》:基于氢键纳米团簇的仿蛛丝水凝胶微纤维 2024-04-21
- 北京化工大学蔡晴/喻盈捷 AFM:三重生物粘附性微球赋能金属离子工程化外泌体疗法,实现血管化骨再生 2026-02-18
