致密及坚硬的细胞外基质促进肿瘤细胞的生长、转移以及对药物的耐受。肿瘤组织升高的间质液压和固体压力阻碍药物及治疗性细胞在肿瘤部位的渗透和分布。因此,调控肿瘤细胞外基质及肿瘤微环境是改善肿瘤治疗响应的一个重要策略。然而,如何调控肿瘤细胞外基质并增强肿瘤对药物的治疗响应是一个重大的挑战。
传统的肿瘤微环境调控集中于细胞外基质的降解和血管的调控,包括使用透明质酸酶、胶原酶等直接降解肿瘤细胞外基质;通过小剂量血管靶向抗体调控肿瘤血管,舒张血管压力,裁剪枝化血管等。在前期的研究中,作者团队发现某些蛋白和药物可以同时实现肿瘤间质液压和固体压力降低、肿瘤血管舒张和肿瘤血管密度增加(Nano Lett. 2020, 20, 6526-6534; Theranostics 2019, 9, 24; Biomater. Sci. 2020, 8, 3907)。尽管这些手段都可以改善肿瘤的微环境,进而提高药物在肿瘤内的富集和渗透,但其特异性仍然有待加强。
近日,蒋锡群教授团队提出了一种多受体介导的肿瘤细胞外基质主动调控(mRMM-ECM)策略,用于阻断肿瘤细胞的信号进而软化肿瘤细胞外基质、颠覆肿瘤微环境。他们利用基因工程的方法,将表皮生长因子受体(EGFR)的纳米抗体和整合素的配体RGD与类弹性蛋白进行融合,构建了一种可以同时靶向EGFR 和整合素αvβ3两种受体的重组蛋白(RP-ER)和重组蛋白药物偶联体(RPDC-ER)。通过同时阻断肿瘤细胞表面过表达的EGFR 和整合素受体,实现了对肿瘤细胞和肿瘤细胞外基质的调控,降低了肿瘤细胞中的F-actin,削减了肿瘤细胞外基质中胶原的含量,提高了药物在细胞间的传输和在3D大细胞球(> 500微米)中的渗透。EGFR 和整合素αvβ3的同时靶向还逆转了肿瘤的物理微环境,在5种肿瘤模型中降低了肿瘤的间质液压、固体压力和杨氏模量,促进了大分子药物在肿瘤组织中的渗透和分布,提高了RPDC的肿瘤治疗效果。该研究提出的多受体介导的肿瘤细胞外基质主动调控策略和RPDC药物平台将有助于克服传统抗体和ADC药物面临的“结合位点障碍”(binding-site barrier)和瘤内渗透性差的缺点,为设计新型抗体及抗体药物偶联体,增强其药物的瘤内递送和分布提供了新思路。

图1. (A) RP-ER 和RPDC-ER的结构示意图,(B) WB分析不同RP处理对HeLa细胞的受体和信号分子的影响,(C) 不同RP处理后的HeLa细胞中的F-actin染色。
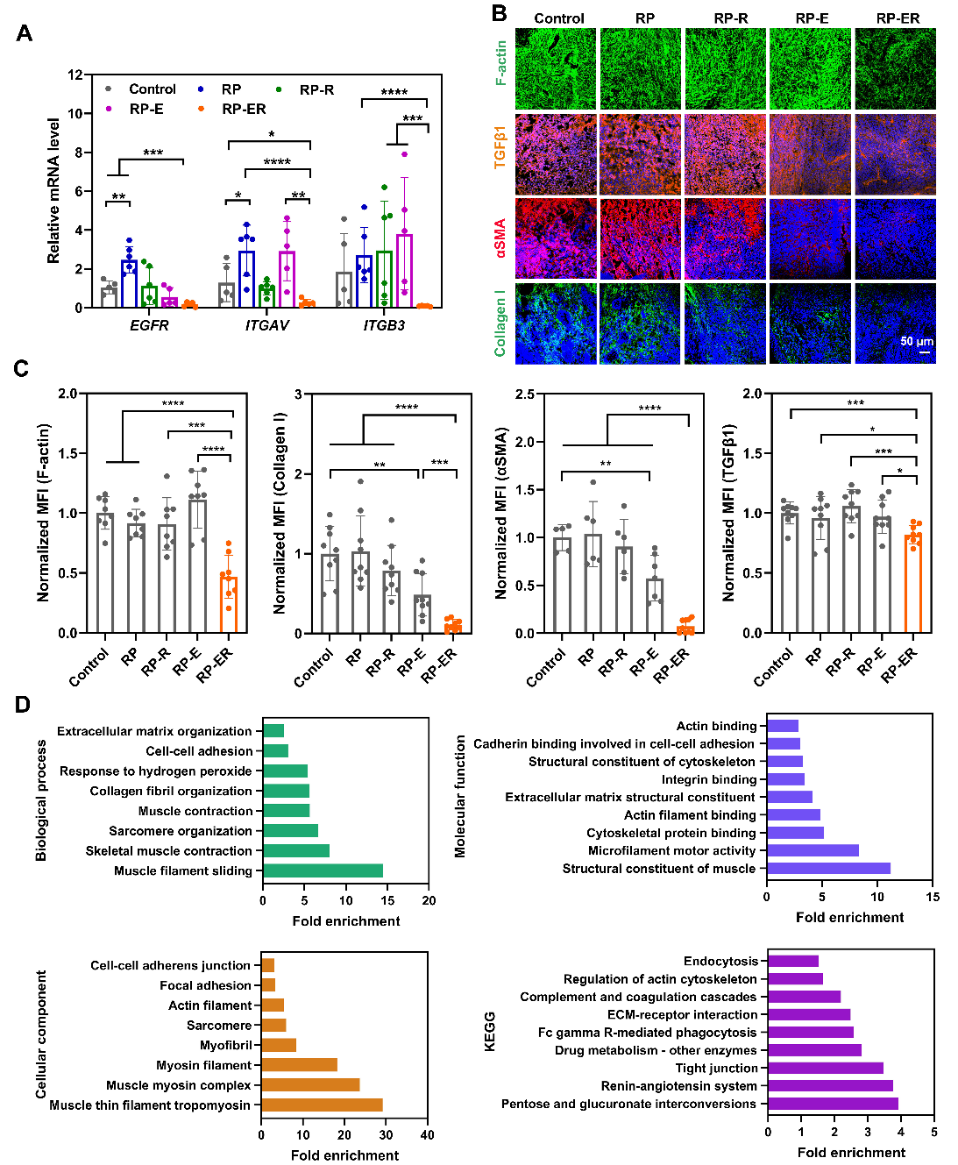
图2. (A) 不同RP处理后HeLa肿瘤组织中细胞受体的mRNA表达情况,(B,C) 不同RP处理后HeLa肿瘤组织中的F-actin、TGFβ1、αSMA、Collagen I的表达情况。(D) RP-ER 处理后的HeLa肿瘤组织对未处理组相比的蛋白质组学分析。
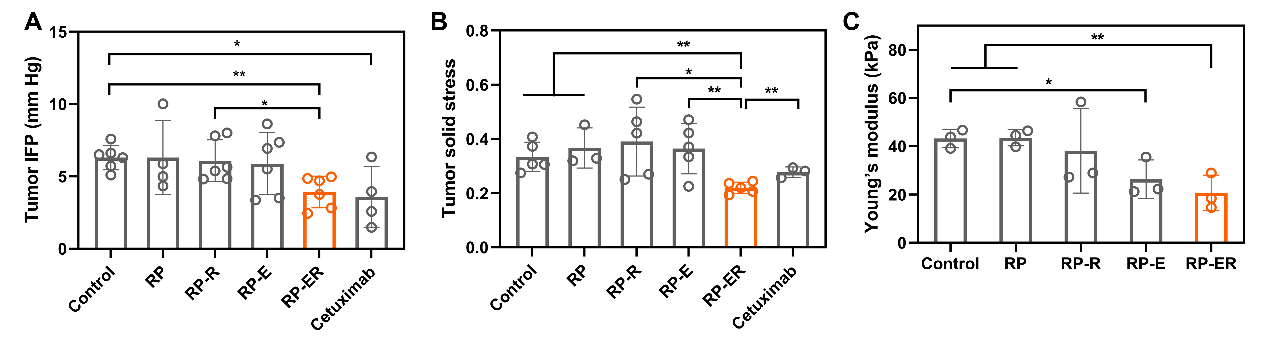
图3. 不同RP处理后HeLa肿瘤的IFP (A)、固体压力 (B)和杨氏模型 (C)。

图4. (A)跨细胞转运实验示意图,(B,C)不同RPDC与HeLa细胞孵育后跨细胞转运的CLSM图和荧光定量分析,(D) RPDC-ER在HeLa细胞中的跨细胞转运效率,(E-N) 不同RPDC在HeLa细胞球中的渗透情况。

图5. (A) 不同RPDC注射进小鼠体内后肿瘤血管处的药物渗透情况,(B) A图中血管外矩形区域的荧光强度随时间的变化,(C) 血管中和(D)血管外100 μm处的荧光强度的变化。
上述相关成果已以“Modulating Tumor Extracellular Matrix by Simultaneous Inhibition of Two Cancer Cell Receptors”为题在Advanced Materials (DOI: 10.1002/adma.202109376 )在线发表,南京大学陈伟芝副研究员为第一作者,蒋锡群教授为通讯作者,埃默里大学的毛辉教授和南京鼓楼医院的刘宝瑞教授对该项工作给与了帮助。该工作获得了国家重点研发计划、国家自然科学基金以及江苏省前沿引领项目的支持。
原文链接:https://doi.org/10.1002/adma.202109376
- 华南理工大学赵鹏超、边黎明《Mater. Today》: 液泡化凝聚层调节大分子药物释放动力学 2023-04-30
- 南京大学鼓楼医院赵远锦团队《Adv. Mater.》:发明微针机器人-攻克口服胰岛素难题 2021-09-18
- 浙江大学王本/唐睿康Angew:可诱导癌细胞钙化的大分子抗肿瘤药物 2021-01-19
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
