在抗击实体肿瘤以及理解聚集诱导发射(AIE)光催化剂的光催化机制的征途中,研究人员取得一项新的突破:巴黎高科化学学院(Chimie ParisTech – PSL university)和法国国家科学研究中心(CNRS)联合实验室IRCP的李敏慧教授团队成功研发出一种无金属纳米酶,即使在缺氧环境中也能通过其光催化特性有效破坏癌细胞的代谢系统。
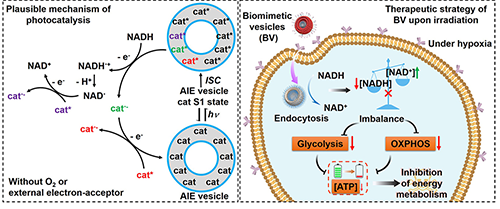
图一. 左图:在无氧条件下,基于仿生无金属纳米酶介导的光催化NADH氧化反应的可行机制。具有AIE特征的分子聚集是关键。右图:在癌细胞乏氧的微环境下,仿生无金属纳米酶进入癌细胞并切断细胞代谢,使癌细胞陷入“能量崩溃” 。
“类酶”光催化,精准打击癌细胞“能量中枢”
癌细胞生长离不开持续的能量供应。为了切断其“燃料通路”,李敏慧教授及其团队,设计出一种光激活的仿生无金属纳米酶。这种纳米酶模拟天然酶的功能,能够精准干扰 NAD?/NADH 的动态平衡。 NAD?和NADH是维系细胞能量代谢的关键分子,一旦平衡被打破,癌细胞将陷入 “能量崩溃” ,最终难逃死亡命运。
无氧也高效,突破实体肿瘤治疗瓶颈
传统的光催化疗法往往依赖氧气作为电子受体,难以在实体肿瘤常见的“低氧”环境中发挥作用。而本次研发的纳米酶技术则突破了这一限制:其核心由两亲性聚合物自组装而成,并整合了具备AIE特性的光催化分子。在无氧以及无其它电子受体的条件下,这些催化剂分子能够在AIE的特殊环境下,通过自身之间的电子转移实现循环再生,驱动持续催化反应,从而在实体肿瘤的复杂微环境中依然具备优异疗效。
靶向精准、毒性可控,展现临床转化潜力
为了提高治疗选择性并降低副作用,研究团队将叶酸靶向肽修饰的红细胞膜包被在纳米酶表面,实现对癌细胞的主动靶向。这种“伪装”策略不仅增强了生物相容性,还显著提升了肿瘤定位效率。经体外细胞实验及小鼠肿瘤模型验证,该策略可有效诱导肿瘤组织发生能量危机,明显延缓癌症进展。
本研究由法国巴黎文理大学巴黎高科化学学院(Chimie ParisTech)与中国暨南大学(广州)联合开展并发表在Journal of the American Chemical Society期刊上,彰显了前沿化学技术在癌症精准治疗领域的巨大潜力。通过设计智能、可控的类酶纳米系统,科研人员正在为实体肿瘤治疗打开新思路。文章第一作者为巴黎文理大学的博士生马燕东,通讯作者为李敏慧教授和暨南大学的纪鑫副教授,巴黎文理大学的邓亚奎博士和暨南大学的薛巍教授也参加了工作。
了解更多,请参看: Yandong Ma, Yakui Deng, Wei Xue, Xin Ji, Min-Hui Li, An Anaerobic Biomimetic Metal-free AIE Polymersome Nanozyme as NADH Oxidase Mimic for Photocatalytic Tumor Suppression by Impairing Cancer Cell Energy Metabolism under Hypoxia, Journal of the American Chemical Society (JACS), accepted on July 7, 2025. https://doi.org/10.1021/jacs.5c06533
了解该组相关工作,请参看: Nian Zhang, Sylvain Trépout, Hui Chen, Min-Hui Li, AIE Polymer Micelle/Vesicle Photocatalysts Combined with Native Enzymes for Aerobic Photobiocatalysis. Journal of the American Chemical Society (JACS), 2022, 145(1), 288-299. https://doi.org/10.1021/jacs.2c09933
