天然关节软骨具有优异的力学承载与关节润滑性能,然而,由意外创伤、年龄增长等原因导致的骨关节炎(OA)会破坏软骨的结构与功能。此外,软骨独特的无血管、无神经等性质会使得受损的关节软骨难以实现完全的自我修复。因此,设计具备关节软骨优异的力学承载关节润滑性能、且可以克服OA带来的炎症环境的人工材料,是目前应对OA治疗的一个关键。
近期,四川大学高分子科学与工程学院李建树教授团队根据关节软骨中普遍存在的透明质酸/硫酸软骨素/硫酸角质素/润滑素等生物大分子的化学组成,采用仿生策略,制备了一种富含羧酸基团和磺酸基团的聚阴离子水凝胶(“CS”);然后选用金属阳离子(主要是Fe3+)对水凝胶进行二次交联,从而为水凝胶提供抗剪切性能和力学适配性能、可控润滑性能和炎症调节性能(图1)。

图1. 软骨启迪的水凝胶设计示意图
实验结果表明,由于丙烯酸(AAc)和3-磺酸丙基甲基丙烯酸钾(SPMK)两种单体的竞聚率的差异,会在水凝形成过程中出现聚合诱导相分离行为,进而呈现“大孔-小孔”交替出现的片层结构。磺酸基团优异的亲水性能协助Fe3+渗透进入水凝胶从而实现与羧酸基团更好的螯合作用。这种“溶胀-交联平衡”策略下的水凝胶(“CS-Fe”)具有最高的Fe3+螯合和最低的Fe3+释放行为。CS-Fe具有理想的弹性行为以及剪切稳定性,且“溶胀-交联平衡”前后的力学性能分别适配软骨表层与深层力学强度。“溶胀-交联平衡”后,“CS-Fe”水凝胶失去润滑性能,但是,可以通过简单的光还原方法将水凝胶的表面的三价铁转换为二价铁,从而实现边界润滑。低浓度Fe3+持续释放可以抑制RAW264.7细胞内的·OH和NO的表达,从而在共培养体系中,保证L929细胞和软骨细胞的正常生长。此外,通过简单的实验设计,可以发现这种润滑水凝胶可以避免滑动过程中摩擦力造成的细胞损伤。
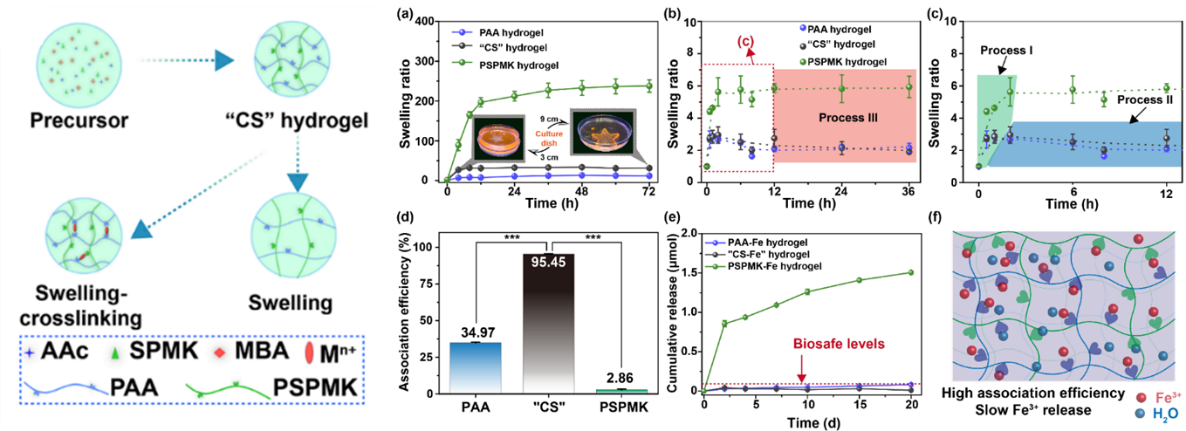
图2. “CS-Fe”水凝胶的制备,左图为示意图。(a)水中溶胀行为,(b-c)Fe3+溶液中的“溶胀-交联平衡”行为,(d)Fe3+结合率,(e)Fe3+释放和(f)机理示意图。

图3. “CS-Fe”水凝胶物理性能。(a-c)抗剪切性能,(d-g)压缩力学性能。

图4. 软骨启迪水凝胶润滑性能。(a-c)“CS”和“CS-Fe”水凝胶摩擦学测试与摩擦系数,(b-c)“CS-Fe”水凝胶表层光还原过程,(d)layered “CS-Fe”水凝胶润滑性。

图5. (a-d)“CS-Fe”水凝胶生物相容性,(e-g)水凝胶炎症调节功能。
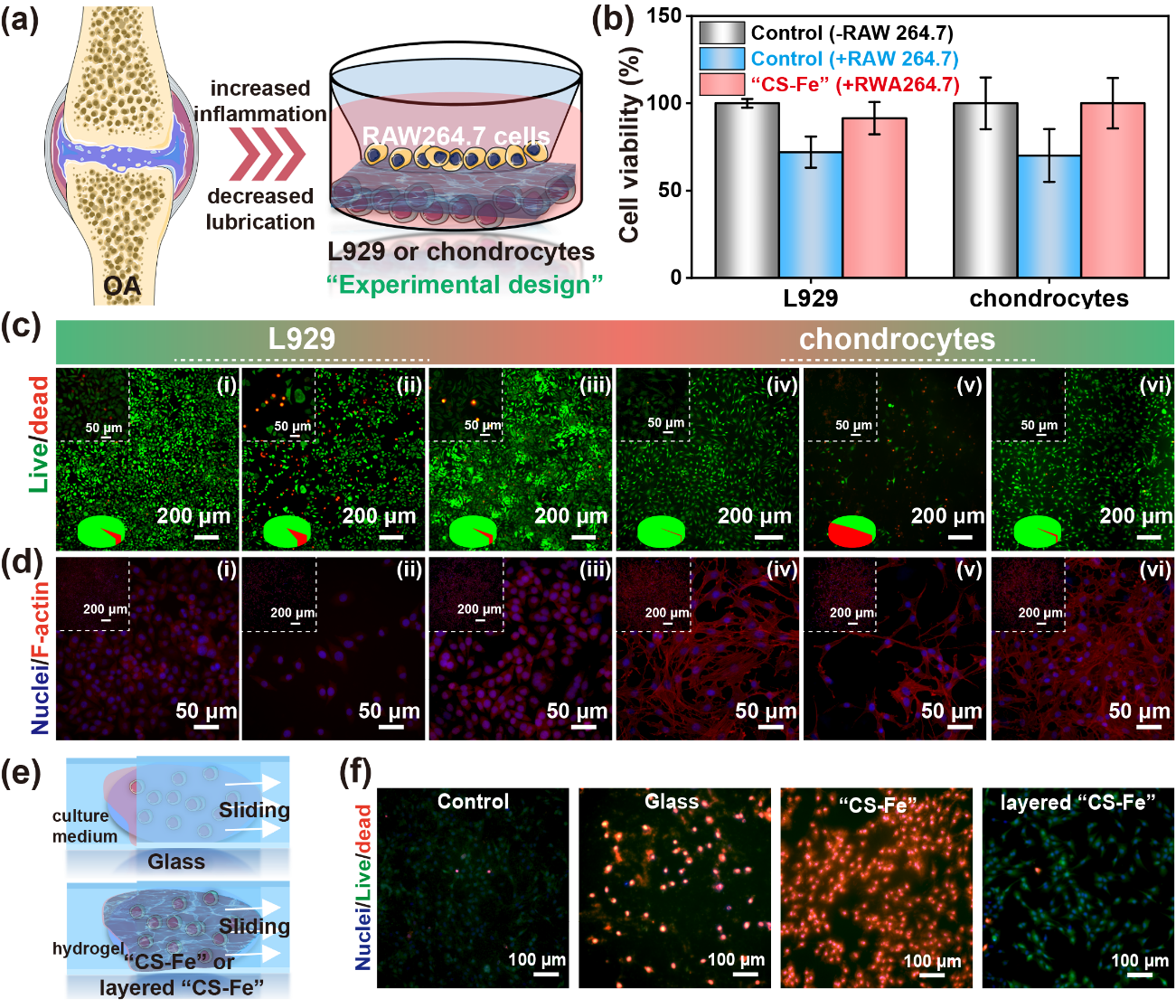
图6. (a-d)模拟OA环境的细胞共培养体系;(e-f)抗摩擦性能。
不同于其他侧重软骨结构仿生的工作,该研究着眼于化学组成的仿生,为OA治疗提供了一种新的思路,也证明了“物理机械性能+抗炎性能”的组合在OA治疗中具有不错的潜力。这为未来OA治疗材料以及软骨组织工程材料的设计提供了借鉴基础。
以上工作以“A Cartilage-inspired Hydrogel with Mechanical Adaptability, Controllable Lubrication and Inflammation Regulation Abilities”为题发表于《ACS Applied Materials & Interfaces》上。2020级博士研究生俞鹏为该论文的第一作者,李建树教授和谢婧副研究员为共同通讯作者。该研究得到了国家自然科学基金(52073191,51925304和52103176)的支持。
原文链接:https://doi.org/10.1021/acsami.2c04609
- 柏林自由大学马楠教授团队 Adv. Funct. Mater.: 水凝胶调节人肝脏类器官细胞谱系 2025-09-01
- 太原理工大学张虎林教授 CEJ:热伏水凝胶实现自供电多功能手部虚拟界面 2025-09-01
- 浙江大学彭玉鑫、许震、明鑫团队 Adv. Sci.: 水下即时粘附水凝胶 - 颠覆水下监测方式 2025-08-30
