CRISPR-dCas9 控制特定靶点基因表达的能力提供了一种通用的“基因开关”工具,可用于研究基因和调控元件的功能,产生不同的细胞类型或状态,并提供合成基因电路设计的强大策略。为了有效控制基因表达,已经开发了三种主要策略来招募效应域:(1)直接将效应域与dCas9融合,(2)将dCas9与多聚肽阵列融合,以通过蛋白质招募相同效应域的多个拷贝-蛋白质相互作用,和(3)用RNA适体修饰sgRNA以通过RNA-蛋白质相互作用募集效应结构域。然而,这些策略旨在提高基于dCas9的转录调控的效率,同时缺乏一个单独的节点来精确控制基于dCas9的系统,这限制了 CRISPR-dCas9 系统实现的复杂合成电路的构建。为此,已经引入了化学或光诱导模块来对CRISPR-dCas9系统进行外部控制,但是可以很容易地编程以感知细胞信号的内部控制方法仍然很少。因此,引入基因模块来实现CRISPR-dCas9系统的内部控制,实现复杂的合成基因电路势在必行。

最近,中国科学技术大学梁好均教授课题组设计了一个基于 dCas9 的转录调控系统,该系统由一个单独的 RNA 模块介导,该模块可以通过 RNA-蛋白质相互作用募集多个转录效应结构域。作为一个单独的组件,RNA 模块充当 dCas9 和效应域之间的桥梁,因此可以设计为生成更复杂的合成电路,用于基于 dCas9 的基因操作的内部控制。此外,与直接将 RNA 适体引入 sgRNA 不同,单独的 RNA 模块可以在不干扰 sgRNA 结构的情况下进行任意修饰。使用这一新系统,进一步提高了基因激活的效率,通过引入与 dCas9 融合竞争分离 RNA 模块的蛋白质,生成了响应内源性 microRNA 的电路,并实现了细胞混合物中的癌细胞识别。这些结果表明,单独的 RNA 介导的 dCas9 系统对于基因调控是有效的,并且对于实施合成电路是灵活的。
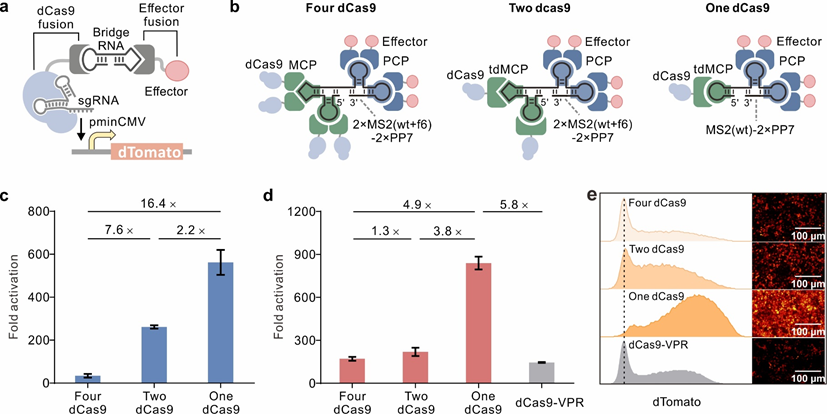
图1.桥 RNA 介导的基于 dCas9 的转录激活复合物的设计和优化。
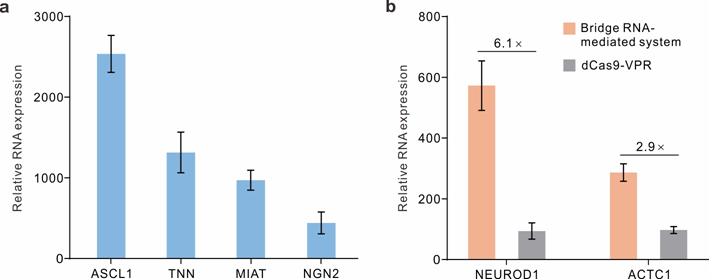
图2.用于 HEK293T 细胞内源基因激活的桥 RNA 介导的 dCas9 平台。
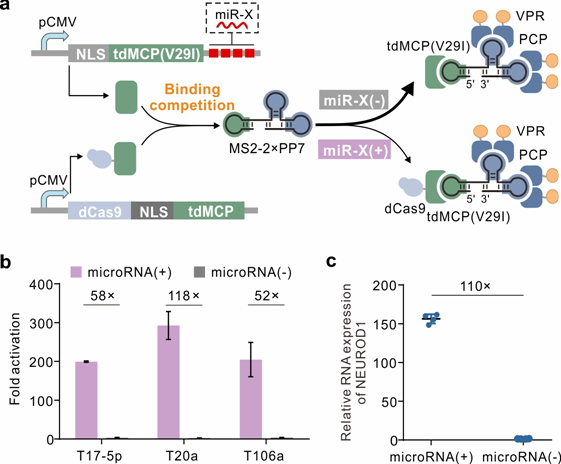
图3.响应 microRNA 操纵基因表达。
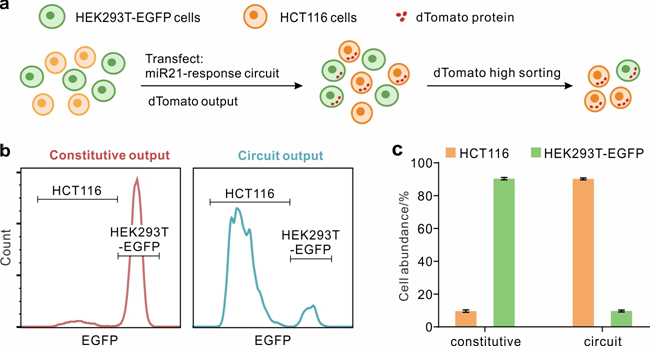
图4.细胞混合物中的 HCT116 细胞鉴定。
这一成果近期发表在J. Am. Chem. Soc. 上(Programmable Transcriptional Modulation with a Structured RNA-Mediated CRISPR-dCas9 Complex, J. Am. Chem. Soc. 2021, DOI: 10.1021/jacs.2c02271)。本文的共同第一作者为何苗博士和周翔博士后,通讯作者为姚东宝特任副研究员、周翔博士后和梁好均教授。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.2c02271
课题组网站:http://staff.ustc.edu.cn/~hjliang/index.html

梁好均,合肥微尺度物质科学国家研究中心研究员,中国科学技术大学高分子科学与工程系教授、博士生导师,2005年国家杰出青年基金获得者。梁好均教授已在Nat. Rev. Methods Primers, P. Natl. Acad. Sci. U.S.A., J. Am. Chem. Soc., Angew. Chem. Int. Edit., Adv. Mater., ACS Nano, Nucleic. Acids. Res. 等高影响力学术期刊上发表论文两百余篇。梁好均教授于2022年2月11日13时10分在安徽合肥不幸离世,享年59岁。深切缅怀梁好均教授,感谢他在高分子模拟、DNA纳米材料以及合成生物学方面的突出贡献。
- 华东理工张大朋教授/李永生教授团队 Angew:器官靶向mRNA递送单组分Janus树枝状大分子载体 2025-04-11
- 中科大王育才/李敏团队 Nat. Biomed. Eng.: 设计低免疫原性mRNA递送载体在体内重编程耐受性APC 2025-04-01
- 中山大学肿瘤医院杨江教授 JCR:可吸入式pH响应型电荷反转聚合物-siRNA复合物用于ALK融合阳性肺癌靶向基因治疗 2025-03-31
- 浙工大吴化平教授团队 AFM: 磁性双稳态水凝胶表面动态可编程调控 2025-08-26
- 芬兰坦佩雷大学郭洪爽博士 Adv. Mater.: 探索集体行为 - 从智能材料到仿生设计 2025-05-04
- 南京大学王炜/曹毅/蒋青/薛斌《Nat. Commun.》:用于干细胞辅助骨再生的具可编程时空力学信号水凝胶 2025-04-20
