近日,ACS Applied Materials & Interfaces (《美国化学学会应用材料与界面》)在线发表了武汉大学药学院田间课题组在光动力抗肿瘤方面的研究成果。该研究设计并制备了一种肿瘤特异性激活的自发光和自供氧功能一体化的光动力治疗纳米体系,在无需激光照射的条件下实现了有效的肿瘤抑制,且表现出了深层肿瘤治疗的巨大潜力。
近年来,光动力治疗(PDT)因其具有高时空选择性、低侵袭性和广谱的抗肿瘤作用等优势,已经成为一种非常有前途的抗肿瘤策略。然而,该策略受到激发光穿透深度不足、肿瘤组织缺氧和光敏剂易聚集的限制,极大地降低了抗肿瘤效率。基于此,武汉大学药学院田间课题组设计并制备了一种多级孔卟啉金属有机骨架纳米粒子作为纳米光敏剂,并高效负载小分子化学发光剂和携氧蛋白。在肿瘤部位,该纳米体系可以被高浓度H2O2特异性激活,并通过化学发光共振能量转移实现自发光成像,实时监测光动力治疗。此外,该纳米体系可以催化化学发光,且携带氧气,以进一步增强成像和治疗效果。该新型一体化纳米体系整合了光动力治疗的三个关键元素(光敏剂、氧气和激发光),有效克服了光动力治疗的缺陷,具有高效的广谱抗肿瘤作用,为深层肿瘤治疗提供了一种有效的策略。
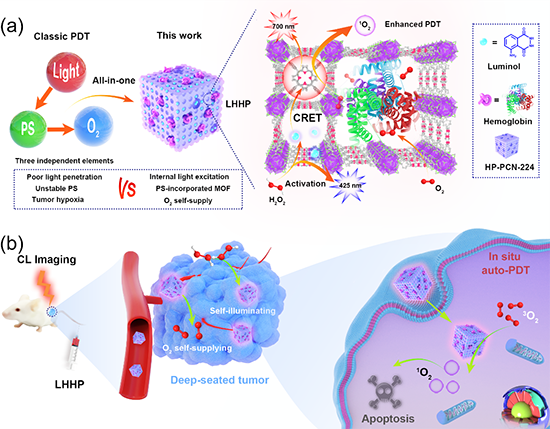
自发光自供氧型“一体化光”动力治疗纳米体系的构建和抗肿瘤应用
在本研究中,多级孔的纳米级卟啉金属有机骨架(HP-PCN-224)可以高效共同封装化学发光小分子Luminol和大分子酶活性血红蛋白(Hb),从而成功制备得到LHHP纳米体系,并应用于化学发光能量共振转移(CRET)介导和自供氧型高效的肿瘤光动力治疗。HP-PCN-224纳米粒子不仅作为小分子和蛋白酶的载体,而且作为纳米光敏剂,有效提高了光敏剂的稳定性。肿瘤微环境中高浓度的H2O2特异性触发LHHP纳米体系中Luminol发出蓝色荧光,通过CRET过程,HP-PCN-224纳米粒子中的卟啉配体被激活并发射近红外荧光,同时激发态能量转移到Hb携带的大量氧气以产生具有细胞杀伤效果的活性氧。此外Hb还可以催化Luminol-H2O2反应,有利于增强成像和光动力治疗效果。体外和体内实验表明LHHP纳米粒子在无外部光照射下即可发挥有效的PDT抗肿瘤作用。这种具有肿瘤特异性激活的自发光和自供氧功能一体化的MOF-酶纳米系统为推进深部肿瘤PDT治疗提供了新的研究思路。
论文链接:https://doi.org/10.1021/acsami.3c02929
- 浙江理工大学应玉龙、王晟/布拉格化工大学Zdenek Sofer:表面活性剂介导的晶体结构演化及铋基金属有机骨架水相超快绿色合成 2023-12-17
- 北京化工大学刘惠玉教授与首医大宣武医院杨旗教授合作:RGD肽偶联的金属有机骨架衍生的类卟啉介孔碳球用于双光疗溶栓 2019-07-20
- 吉林师范大学许彦红教授、谢伟讲师及新加坡国立大学江东林教授:多孔有机聚合物和金属-有机骨架材料用于碘捕获的研究进展 2019-05-17
- 吉林大学钱虎军教授团队 PRL:单链纳米粒子突破高分子材料“强度-韧性-加工性”三难困境 2025-10-15
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 华工殷盼超/广工尹家福团队 Nano Lett.:软纳米粒子多时空动力学解析 2025-08-21
- 香港中文大学(深圳)唐本忠院士团队 ACS Nano:基于AIEgen的可见光穿透器用于深层组织感染的光动力治疗 2024-10-21
