化疗-免疫联合治疗是抑制肿瘤术后复发和转移的重要治疗方式,但是目前仍存在生物相容性不佳,靶向性差和副作用严重等问题。因此,亟待发展一种能够靶向肿瘤术后部位的递送策略,提高药物在肿瘤部位的富集量。肿瘤术后急性炎症是术后部位的显著特点,可以募集大量中性粒细胞到达术后部位。因此,中性粒细胞是一种理想的术后部位药物递送工具。在过去的研究中,通常是把中性粒细胞提取出来,体外进行药物分子负载,然后再回输到体内。但是这种策略存在着中性粒细胞分离困难,寿命较短以及药物负载过程复杂等问题。
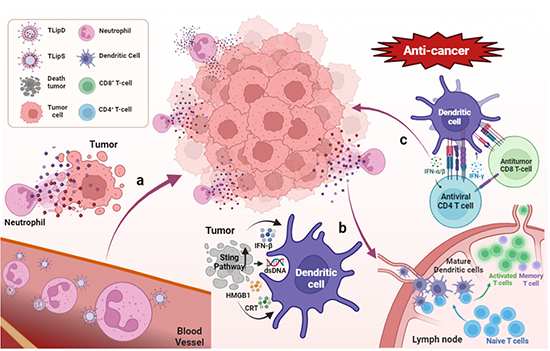
图1. 原位中性粒细胞“搭便车”策略递送DOX和SR717的过程及化疗-免疫联合治疗示意图。

图2. (a)TLipD和TLipS脂质体纳米颗粒制备过程示意图及构筑单元的结构式;LipD,LipS,TLipD和TLipS颗粒的(b)粒径和(c)Zeta电位;(d)TLipD和(e)TLipS颗粒的cryo-TEM图片;(f)不同时间点血液中中性粒细胞的占比;(g)不同时间点肿瘤组织中中性粒细胞的占比;(h)6 h, 12 h和24 h时肿瘤组织中中性粒细胞浸润情况。

图3.(a)脂质体在血液中原位靶向中性粒细胞及肿瘤组织术后靶向递送验证图;血液及肿瘤部位脂质体纳米颗粒靶向中性粒细胞的流式细胞分析图(b)及定量统计图(c); 6 h,12 h和24 h时,肿瘤组织处的平均荧光强度统计图(d)和荧光成像照片(e);(f)靶向和非靶向脂质体纳米颗粒在术后和非术后肿瘤部位的药物积累量统计图;(g)TLipD,TLipS和TLipDS脂质体纳米颗粒对B16的细胞毒性;(h)B16细胞和载药中性粒细胞共孵育后的药物细胞间传递成像照片。
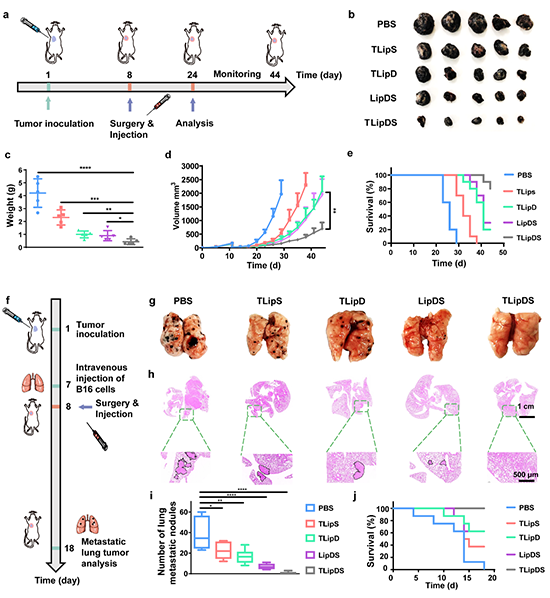
图 4. (a)B16小鼠肿瘤模型治疗过程示意图;(b)B16小鼠术后肿瘤模型治疗后(b)肿瘤照片和(c)肿瘤质量图;治疗过程中小鼠(d)肿瘤体积变化和(e)存活率图;(f)肺转移瘤治疗过程图;治疗结束后小鼠(g)肺部照片,(h)肺部H&E切片和(i)肺部转移灶个数统计图;(j)肺转移模型小鼠生存率统计图。
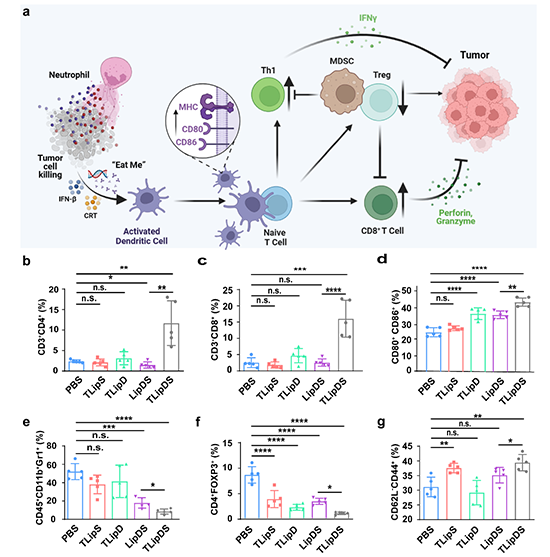
图5. (a)DOX和SR717“搭便车”递送到肿瘤部位后免疫微环境变化示意图。PBS、TLipS、TLipD、LipDS或TLipDS治疗后肿瘤中CD3+CD4+(b)和CD3+CD8+(c)T细胞的百分比。(d) 治疗后淋巴结中CD80+CD86+DC在总CD11c+DC中的百分比。CD45+CD11b+Gr1+(e)、CD4+Foxp3+(f)和CD62L-CD4+(g)T细胞在肿瘤中总T细胞中的百分比。
在术后B16荷瘤小鼠上评估了对肿瘤复发的抑制作用。与其他组相比,TLipDS组能很好地控制肿瘤的复发和生长。为了进一步评估脂质体基靶向纳米递送体系的治疗效果,建立了小鼠肺转移肿瘤模型。PBS、TLipS或TLipD组处理的小鼠的肺组织具有明显的黑色素瘤转移灶。相反,在TLipDS组中计划观察不到肺转移灶的出现,这表明TLipDS可以有效抑制转移性肿瘤细胞的生长(图4)。为了证明ICD和STING通路激活引起的抗肿瘤免疫,研究者测定了肿瘤内免疫细胞的浸润。与其他组相比,TLipDS组诱导辅助T淋巴细胞(CD3+D4+)和细胞毒性T细胞(CD3+CD8+)的比例最高。这表明增强靶向递送效率和STING激动剂联合递送可有效激活免疫反应。此外,研究者对DC在肿瘤引流淋巴结中的成熟水平进行了研究用来证明联合治疗机制。与其他组相比,DOX和SR717的共递送可诱导更高水平的DC成熟。骨髓来源的抑制细胞(MDSCs)和调节性T细胞的肿瘤浸润(Tregs)在抗肿瘤免疫反应中也起到了至关重要的作用。此外,研究者对肿瘤组织处的免疫记忆细胞水平也进行了进一步分析,TLipS和TLipDS组的效应记忆T细胞(CD62L?CD44+)水平明显提高。而与PBS组相比,LipDS和TLipD组没有记忆T细胞水平没有显著差异(图5)。
本工作提供了一种术后化疗-免疫联合治疗的“搭便车”递送策略。DOX不仅可以通过直接化疗抑制肿瘤生长,而且可以诱导ICD。释放的免疫原性物质(如dsDNA)可以激活STING通路,共递送的SR717可以进一步放大信号以诱发强大的特异性抗肿瘤免疫反应。重要的是,由于治疗后特异性抗肿瘤免疫记忆的激活,靶向联合治疗组还表现出了对肺转移瘤生长的有效抑制。通过“搭便车”递送策略可有效提高纳米药物的靶向递送效率。同时,化疗药物和免疫佐剂的联合递送还能够激活强大的抗肿瘤免疫反应,有效抑制肿瘤的术后复发和转移瘤的生长。
原文链接:https://doi.org/10.1016/j.nantod.2023.102096
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 山东大学刘新宇、崔基炜教授交叉团队 ACS Nano:靶向递送与肝-骨轴调控协同治疗骨质疏松 2025-06-29
- 长春应化所陈学思/宋万通团队《Mater. Horiz.》:基于聚氨基酸的脾靶向递送mRNA的磷脂酰聚合物文库 2024-04-03
- 浙江大学高建青教授课题组《Adv. Funct. Mater. 》:在干细胞膜仿生囊泡多功能化和靶向递送上取得新进展 2020-09-22
- 温医大纪建松/苏大刘庄、冯良珠 Adv. Sci.:肿瘤碎片驱动的胆固醇靶向催化水凝胶可增强微波消融联合抗肿瘤免疫反应疗效 2024-12-16
