浙大周民教授团队 Bioact. Mater.:微藻药物递送系统"降尿酸-抗炎-消化系统保护"三位一体协同用于痛风性关节炎的治疗
2025-06-04 来源:高分子科技
痛风性关节炎(Gouty Arthritis, GA)是由尿酸代谢异常导致尿酸盐(MSU)结晶在关节及周围组织沉积所引发的炎症性疾病。该疾病以关节剧烈疼痛、肿胀和活动受限为主要临床表现,已成为全球最常见的炎症性关节疾病之一。流行病学数据显示,过去二十年间其发病率增长超过两倍,严重影响患者生活质量。当前该疾病的临床治疗面临两大难题:一线药物秋水仙碱(Col)虽具有良好的抗炎效果,但其治疗剂量接近中毒剂量,约20%患者会出现腹泻、呕吐等胃肠道不良反应;此外,目前尚无药物能够同时干预高尿酸血症(HUA)和关节炎症两个病理过程。
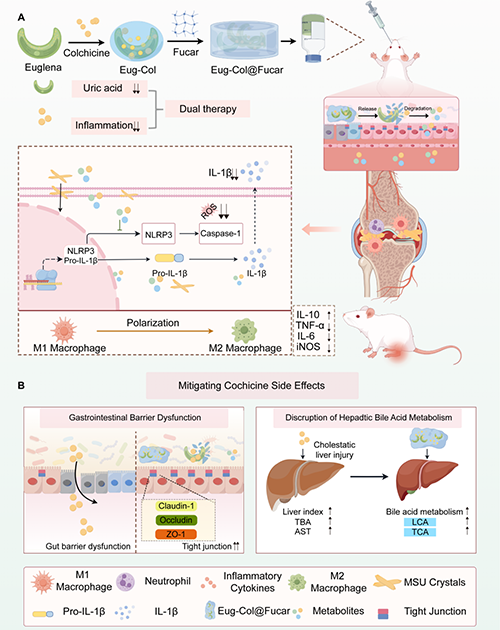
针对上述问题,浙江大学州民教授团队开发了一种基于开发了一种基于裸藻(Eug)、秋水仙碱(Col)和岩藻糖卡拉胶复合物(Fucar)的口服水凝胶系统(Eug-Col@Fucar) 将裸藻的尿酸吸附特性、岩藻糖卡拉胶复合物的肠道保护功能与秋水仙碱的抗炎作用有机结合。首次实现了"降尿酸-抗炎-消化系统保护"三位一体协同治疗,为痛风患者提供了更安全高效的治疗方案。实验结果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促进巨噬细胞向M2型抗炎表型极化,抑制NLRP3-IL-1β信号通路,从而改善痛风性关节炎。此外,该系统显著缓解了秋水仙碱引起的胃肠道不良反应,如胃肠绒毛结构异常和屏障通透性增加等问题。由于富含多糖成分,该水凝胶系统还能改善胆汁酸代谢,从而减轻秋水仙碱诱导的肝毒性。此外,安全性评估也证实了该复合物的良好生物相容性,为未来临床应用奠定了基础。

该文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》为题发表于《Bioactive Materials》上。
本研究开发了一种Eug-Col@Fucar水凝胶系统,用于共同传递Eug和Col,制得了更加稳定和均匀的制剂。该水凝胶通过将岩藻糖(Fuc)与不同浓度的卡拉胶(Car)混合,诱导凝胶化。结果表明,随着卡拉胶浓度的增加,水凝胶展现了良好的剪切变稀特性和可注射性,并且凝胶的弹性得到了显著增强。扫描电子显微镜(SEM)图像显示,岩藻糖和卡拉胶通过协同作用形成了致密的凝胶网络,且随着卡拉胶浓度的增加,凝胶孔径减小,从而提高了凝胶的强度和稳定性。Eug-Col复合物成功地被包载进Fucar水凝胶中,并且在加载后水凝胶呈现绿色,显示出优良的可注射性。体外药物释放实验表明,Eug-Col@Fucar能够有效保护Col免受胃酸的降解,允许在小肠中进行控制释放,从而提高了Col的生物利用度并减少了胃肠道毒性。总体来说,Fucar水凝胶系统对于Eug和Col的口服递送是一个有效的载体。
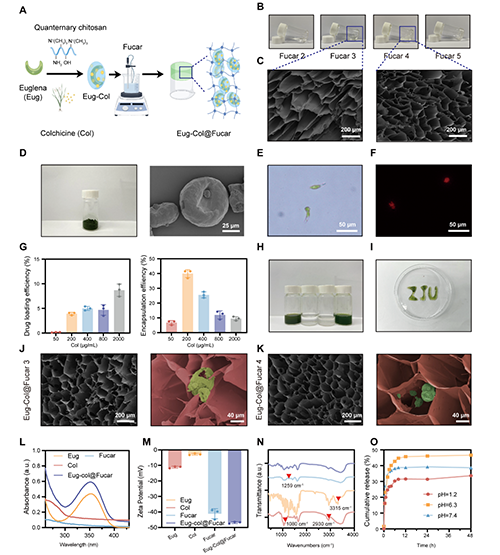 图1. Eug-Col@Fucar的合成与表征。(A) Eug-Col@Fucar合成示意图(B)不同浓度的Fucar水凝胶。(C) Fucar 3和Fucar 4的代表性SEM图像。(D) Eug冷冻照片和Eug的代表性SEM图像。(E) 代表Eug的亮场和(F)荧光图像。(G) Eug-Col溶液的载药效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,Fucar 4水凝胶,Eug-Col@Fucar水凝胶。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM图像低倍放大(左)和高倍放大(右)下。红色:Fucar。绿色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM图像。红色:Fucar。绿色:Eug-Col。(L) Eug的紫外-可见吸收光谱,(M) Zeta电位,(N) FTIR光谱;Col,Fucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累积Col释放量。
图1. Eug-Col@Fucar的合成与表征。(A) Eug-Col@Fucar合成示意图(B)不同浓度的Fucar水凝胶。(C) Fucar 3和Fucar 4的代表性SEM图像。(D) Eug冷冻照片和Eug的代表性SEM图像。(E) 代表Eug的亮场和(F)荧光图像。(G) Eug-Col溶液的载药效率和包封效率。(H) Eug-Col的照片溶液,Col溶液,Fucar 4水凝胶,Eug-Col@Fucar水凝胶。(I) Eug-Col@Fucar的可注射性。(J) Eug-Col@Fucar具有代表性的SEM图像低倍放大(左)和高倍放大(右)下。红色:Fucar。绿色:Eug-Col。(K) Eug-Col@Fucar 4在低放大(左)和高倍放大(右)下的代表性SEM图像。红色:Fucar。绿色:Eug-Col。(L) Eug的紫外-可见吸收光谱,(M) Zeta电位,(N) FTIR光谱;Col,Fucar和Eug-Col@Fucar。(O)Eug-Col@Fucar在不同pH值下PBS中的累积Col释放量。
(2)Eug-Col@Fucar的体外生物相容性及抗氧化作用
Eug(一种富含抗氧化成分的微藻)与Col(治疗痛风的临床药物)在Fucar水凝胶载体中协同作用,能够显著增强细胞活力,并减轻Col的细胞毒性。Eug和Fucar显示了良好的生物兼容性,并促进了细胞的增殖。Eug在清除自由基方面表现优异,并与Col一起对抗氧化应激提供保护。此外,Eug-Col@Fucar系统在体外实验中有效地清除了过氧化氢和自由基,且在LPS诱导的氧化应激中显著减少了ROS的生成,表现出较强的抗氧化作用。总体而言,Eug-Col@Fucar不仅具有较强的抗氧化能力,还能够有效减少氧化损伤,具有在治疗炎症性疾病中的应用前景。
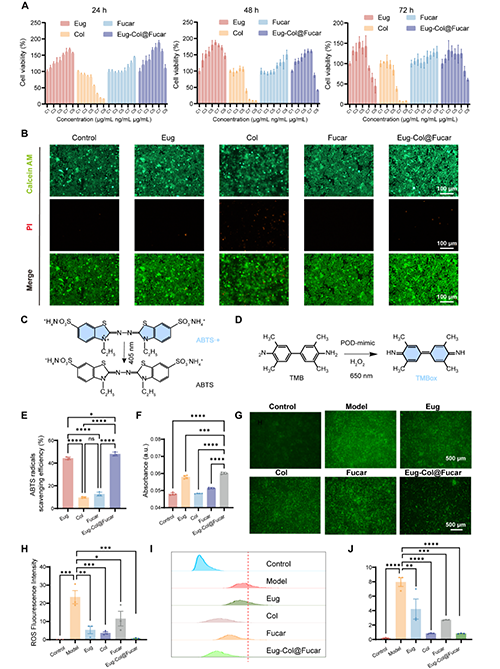 图2.体外生物相容性及抗氧化作用评价。(A)用CCK8法测定不同浓度的Eug、Col、Fucar和Eug-Col@Fucar处理RAW264.7细胞24小时、48小时和72小时细胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar处理RAW264.7细胞24小时的活死染色。(C) ABTS自由基清除实验示意图。(D) TMB法检测过氧化物酶活性示意图。(E)不同材料对ABTS自由基的清除效率。(F)不同处理后650 nm oxTMB吸光度。(G)不同处理后RAW 264.7细胞胞内ROS生成的DCFH-DA染色。(H) RAW 264.7细胞胞内ROS荧光强度定量。(I)不同处理后RAW 264.7细胞ROS生成的流式细胞术分析。(J)流式细胞术分析中平均荧光强度的定量。
图2.体外生物相容性及抗氧化作用评价。(A)用CCK8法测定不同浓度的Eug、Col、Fucar和Eug-Col@Fucar处理RAW264.7细胞24小时、48小时和72小时细胞活力。(B)用Eug、Col、Fucar和Eug-Col@Fucar处理RAW264.7细胞24小时的活死染色。(C) ABTS自由基清除实验示意图。(D) TMB法检测过氧化物酶活性示意图。(E)不同材料对ABTS自由基的清除效率。(F)不同处理后650 nm oxTMB吸光度。(G)不同处理后RAW 264.7细胞胞内ROS生成的DCFH-DA染色。(H) RAW 264.7细胞胞内ROS荧光强度定量。(I)不同处理后RAW 264.7细胞ROS生成的流式细胞术分析。(J)流式细胞术分析中平均荧光强度的定量。
(3)Eug-Col@Fucar巨噬细胞重编程和体外抗炎能力的研究
Eug-Col@Fucar系统在治疗痛风性关节炎(GA)中具有潜力。研究表明,Eug-Col@Fucar能够显著诱导小鼠巨噬细胞从M1型(促炎性)转变为M2型(抗炎性),并且通过这种转化有效地抑制了炎症反应。实验中,Eug-Col@Fucar显著提高了M2型巨噬细胞的比例,减少了M1型巨噬细胞的比例,从而降低了与痛风相关的炎症因子(如TNF-α、IL-6、IL-1β)的表达。与Eug、Col、Fucar单独处理相比,Eug-Col@Fucar表现出更强的抗炎作用,能够有效抑制M1型标志基因的表达,并增强M2型标志基因的表达。因此,Eug-Col@Fucar系统能够有效重编程巨噬细胞,转化为抗炎性的M2型巨噬细胞,为痛风性关节炎的治疗提供了一种理想的生物材料。
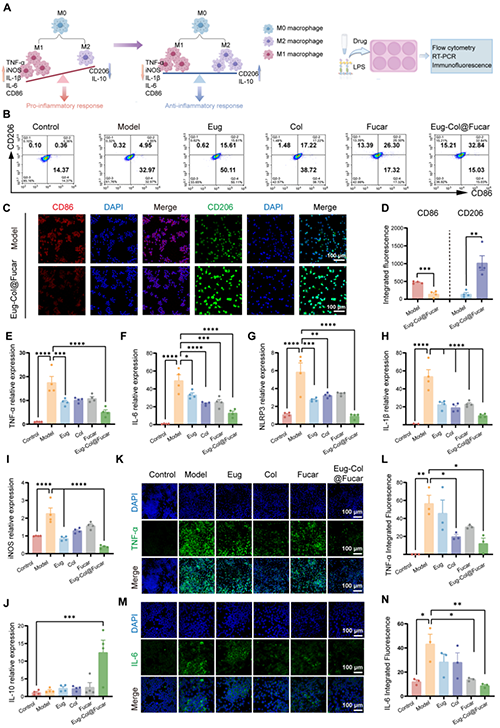 图3. 巨噬细胞重编程及体外抗炎能力评价。(A)巨噬细胞重编程示意图。(B) Eug、Col、Fucar和Eug-Col@Fucar处理后的M1和M2巨噬细胞比例的流式细胞术分析。(C)免疫荧光染色和(D) Eug-Col@Fucar处理后CD86 (M1标记,红色)和CD206 (M2标记,绿色)的定量。(e) qPCR检测M1巨噬细胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表达。(J) qPCR检测M2巨噬细胞基因(IL-10)的表达。(K) 不同处理后TNF-α(绿色)的免疫荧光染色。(L) TNF-α的相对荧光强度定量。(M)不同处理后IL-6(绿色)的免疫荧光染色。(N)定量IL-6的相对荧光强度。
图3. 巨噬细胞重编程及体外抗炎能力评价。(A)巨噬细胞重编程示意图。(B) Eug、Col、Fucar和Eug-Col@Fucar处理后的M1和M2巨噬细胞比例的流式细胞术分析。(C)免疫荧光染色和(D) Eug-Col@Fucar处理后CD86 (M1标记,红色)和CD206 (M2标记,绿色)的定量。(e) qPCR检测M1巨噬细胞基因(TNF-α、IL-6、NLRP3、IL-1β和iNOS)的表达。(J) qPCR检测M2巨噬细胞基因(IL-10)的表达。(K) 不同处理后TNF-α(绿色)的免疫荧光染色。(L) TNF-α的相对荧光强度定量。(M)不同处理后IL-6(绿色)的免疫荧光染色。(N)定量IL-6的相对荧光强度。
(4)Eug-Col@Fucar的荧光成像性质及生物分布
Eug-Col@Fucar在口服给药后的生物分布研究表明,该复合材料能够有效延长药物在体内的滞留时间,促进药物的吸收并增强治疗效果。通过荧光成像观察发现,Eug-Col@Fucar主要分布在小肠,尤其是回肠,并且在24小时内,Eug-Col@Fucar在小肠的荧光信号强度和持续时间显著高于自由的Eug和Col。此外,未在主要器官(如心脏、肝脏、脾脏、肺和肾脏)中检测到Eug积聚,说明Eug-Col@Fucar在口服后主要在胃肠道内发挥作用。通过定量分析发现,虽然Fucar涂层使FITC的荧光强度有所降低,但Eug-Col@Fucar组在24小时后的信号更为显著,表明Col的滞留时间得到了延长。冻切片的肠道组织进一步证明了Eug-Col@Fucar能够有效地保持Eug和Col的荧光信号,且与单独使用Eug和Col的组相比,表现出更强的荧光。在降解过程方面,Eug-Col@Fucar在胃肠道内表现出优异的生物降解性。其在小肠和盲肠逐渐解体,到达结肠时几乎完全降解,证明了其良好的生物可降解性。综上所述,Eug-Col@Fucar能够有效延长药物在体内的滞留时间,增强药物吸收,并且具有优异的生物降解性,显示出其作为口服给药系统的潜力。
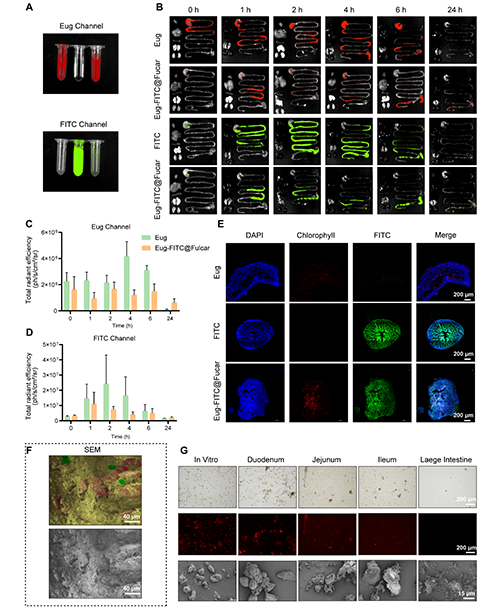 图4. Eug-FITC@Fucar的荧光成像及生物分布。(A) 在Eug通道和FITC通道下,FITC、Eug和Eug-FITC@Fucar的体外荧光成像(B) 分别在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小时小鼠主要器官(心、肝、脾、肺、肾和胃肠道)的代表性荧光图像。(C) Eug通道和(D) FITC通道下各时间点的荧光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置肠道组织冷冻切片的代表性荧光图像。(F) 灌胃Eug-Col@Fucar后小鼠肠道组织代表性SEM(下)和伪彩色SEM(上)图像。(G) 小鼠胃肠道不同部位内容物代表性亮场显微镜图像(上)、荧光图像(中)和SEM图像(下)。
图4. Eug-FITC@Fucar的荧光成像及生物分布。(A) 在Eug通道和FITC通道下,FITC、Eug和Eug-FITC@Fucar的体外荧光成像(B) 分别在Eug通道和FITC通道下口服FITC、Eug或Eug-FITC@Fucar(等量FITC或Eug) 0、1、2、4、6和24小时小鼠主要器官(心、肝、脾、肺、肾和胃肠道)的代表性荧光图像。(C) Eug通道和(D) FITC通道下各时间点的荧光定量。(E) 小鼠灌胃后。Eug 、FITC和Eug-FITC@Fucar后同一位置肠道组织冷冻切片的代表性荧光图像。(F) 灌胃Eug-Col@Fucar后小鼠肠道组织代表性SEM(下)和伪彩色SEM(上)图像。(G) 小鼠胃肠道不同部位内容物代表性亮场显微镜图像(上)、荧光图像(中)和SEM图像(下)。
(5)Eug-Col@Fucar治疗急性痛风性关节炎的疗效
Eug-Col@Fucar在高尿酸血症(HUA)诱导的痛风性关节炎(GA)小鼠模型中表现出了显著的治疗效果。与模型组相比,Eug-Col@Fucar组在减轻关节肿胀、缓解机械性痛觉过敏、改善步态以及减轻骨损伤方面表现更为显著。特别是,Eug-Col@Fucar组在48小时后,关节肿胀程度与对照组相近,远优于单独使用Eug、Col和Fucar的组。此外,Eug-Col@Fucar组的尿酸水平显著低于模型组,而Col组的尿酸水平未能显著降低。Eug-Col@Fucar通过持续释放Eug和Col,有效减轻了由MSU结晶引起的痛风性关节炎的症状,并改善了小鼠的步态障碍。Micro CT分析显示,Eug-Col@Fucar组在关节骨损伤方面明显优于模型组,证明其具有保护骨骼的作用。总的来说,Eug-Col@Fucar不仅能够降低血清尿酸浓度,还能减轻关节炎症、缓解痛感、改善步态障碍,并具有潜力作为治疗痛风性关节炎的双重疗法。
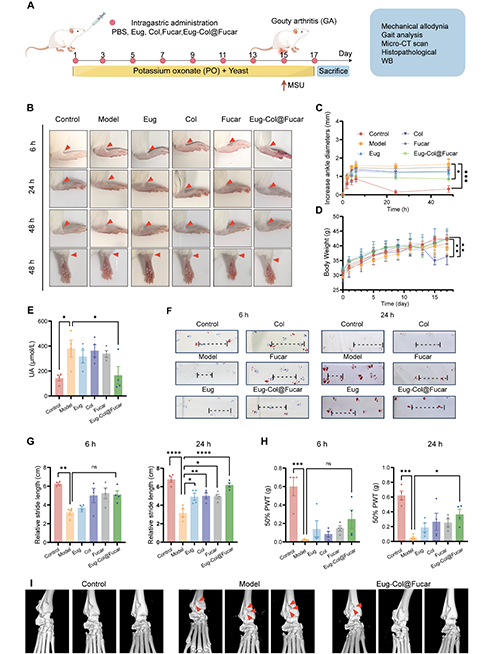 图5. Eug-Col@Fucar对MSU诱导GA伴HUA的治疗作用。(A) 治疗过程示意图。(B) 注射后6、24、48 h,不同治疗组GA小鼠右脚踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在关键时间点(2、4、6、24和48 h) GA小鼠关节直径的变化。(D) 处理期间小鼠体重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar处理的HUA小鼠血清UA水平。(F) 不同组分别在6 h和24 h的步态分析结果。虚线表示步幅。(G) 定量分析不同组痛风性关节炎小鼠在6 h和24 h时的相对步长。(H) 对照组、模型组、Eug组、Col组、Fucar组和Eug-Col@Fucar组50% PWT分别在6 h和24 h时的变化。(I) 对照组、模型组和Eug-Col@Fucar组踝关节代表性显微CT图像。
图5. Eug-Col@Fucar对MSU诱导GA伴HUA的治疗作用。(A) 治疗过程示意图。(B) 注射后6、24、48 h,不同治疗组GA小鼠右脚踝代表性照片。(C) PBS、Eug、Col、Fucar和Eug-Col@Fucar在关键时间点(2、4、6、24和48 h) GA小鼠关节直径的变化。(D) 处理期间小鼠体重。(E) 用Eug、Col、Fucar和Eug-Col@Fucar处理的HUA小鼠血清UA水平。(F) 不同组分别在6 h和24 h的步态分析结果。虚线表示步幅。(G) 定量分析不同组痛风性关节炎小鼠在6 h和24 h时的相对步长。(H) 对照组、模型组、Eug组、Col组、Fucar组和Eug-Col@Fucar组50% PWT分别在6 h和24 h时的变化。(I) 对照组、模型组和Eug-Col@Fucar组踝关节代表性显微CT图像。
(6)对MSU诱导的氧化应激和NLRP3介导的体内炎症的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar显著减少了痛风性关节炎(GA)小鼠模型中关节的中性粒细胞和M1型巨噬细胞的数量,表现出强大的抗炎潜力。与模型组相比,Eug-Col@Fucar组在减轻炎症和细胞浸润方面效果显著。Eug-Col@Fucar通过显著减少NLRP3炎症小体的表达,抑制了MSU结晶引起的炎症反应。Western blot分析显示,Eug-Col@Fucar显著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的过度表达,证明其对NLRP3炎症小体的抑制作用。
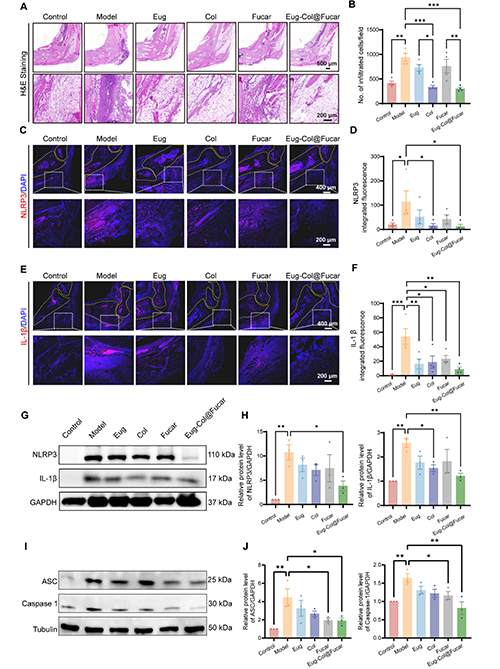 图6. Eug-Col@Fucar对踝关节的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝关节H&E染色。(B)每个观察场浸润炎性细胞数的阳性分析。(C) 低(上)和高(下)放大下踝关节NLRP3的免疫荧光染色。(D) 踝关节NLRP3荧光定量分析。(E)低倍放大(上)和高倍放大(下)踝关节IL-1β免疫荧光染色。(F) 踝关节组织IL-1β荧光定量分析。(G) 不同处理后踝关节组织NLRP3和IL-1β水平的Western blot分析。(H) 踝关节组织中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同处理后踝关节组织中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝关节组织中ASC和Caspase 1蛋白水平的定量分析。
图6. Eug-Col@Fucar对踝关节的抗炎作用。(A) 低倍放大(上)和高倍放大(下)踝关节H&E染色。(B)每个观察场浸润炎性细胞数的阳性分析。(C) 低(上)和高(下)放大下踝关节NLRP3的免疫荧光染色。(D) 踝关节NLRP3荧光定量分析。(E)低倍放大(上)和高倍放大(下)踝关节IL-1β免疫荧光染色。(F) 踝关节组织IL-1β荧光定量分析。(G) 不同处理后踝关节组织NLRP3和IL-1β水平的Western blot分析。(H) 踝关节组织中IL-1β和NLRP3蛋白水平的定量分析。(I) 不同处理后踝关节组织中ASC和Caspase 1蛋白水平的Western blot分析。(J) 踝关节组织中ASC和Caspase 1蛋白水平的定量分析。
(7)对秋水仙碱相关不良反应的保护作用
Col的毒性与副作用:Col的治疗剂量接近其毒性剂量,最常见的毒性表现为胃肠道副作用,如恶心、呕吐和腹泻。在GA治疗过程中,Col处理的小鼠体重显著下降,这可能与其毒性相关。Col处理导致胃和肝脏的器官指数显著增加,提示可能引起胃和肝脏组织的病理改变。而在将Col与Fucar共同封装形成Eug-Col@Fucar后,这两者的器官指数恢复正常,表明Eug-Col@Fucar能够减轻Col对胃和肝脏的损伤。Col处理导致结肠长度缩短,并显著减少了紧密连接蛋白Occludin、Claudin-1和ZO-1的表达,表明Col可能损害了肠道屏障功能。而Eug-Col@Fucar能够显著恢复这些紧密连接蛋白的表达,修复肠道屏障功能。Col组的小鼠胃粘膜上皮细胞丧失,结肠组织的杯状细胞分泌减少,导致结肠屏障通透性增加。此外,Col处理还导致肝细胞轻微的颗粒变形和细胞质松弛。通过HE染色可以看到,Col引起的这些胃肠道和肝脏损伤在Eug-Col@Fucar的治疗下得到了明显改善。
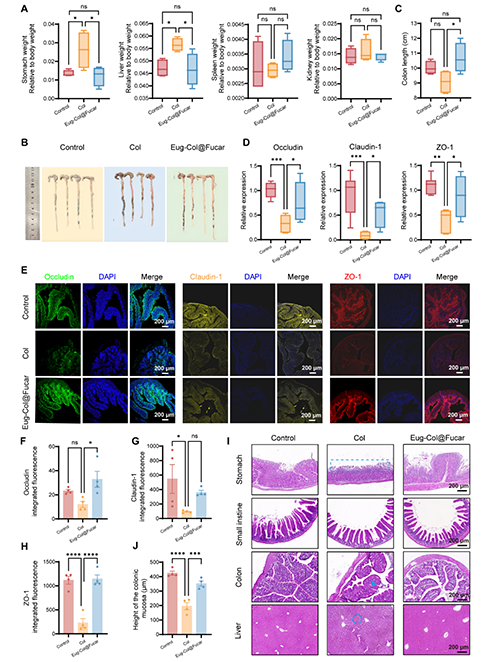 图7. Eug-Col@Fucar减少秋水仙碱的胃肠道副作用。(A)在Control、Col、和Eug-Col@Fucar组的主要器官的器官指数,包括肝、胃、脾、肾。(B)不同组小鼠盲肠和结肠组织中的解剖照片。(C) 结肠长度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表达水平。(E) ,不同组小鼠结肠组织Occludin(绿色)的Claudin-1(黄色)和ZO-1(红色)的荧光图片。不同处理后结肠组织(F) Occludin、(G) Claudin-1、(H) ZO-1荧光定量分析。(I) Control组、Col组、Eug-Col@Fucar组结肠黏膜高度定量分析(n = 4)。(J)不同组胃、小肠、结肠、肝脏组织代表性H&E染色图像。
图7. Eug-Col@Fucar减少秋水仙碱的胃肠道副作用。(A)在Control、Col、和Eug-Col@Fucar组的主要器官的器官指数,包括肝、胃、脾、肾。(B)不同组小鼠盲肠和结肠组织中的解剖照片。(C) 结肠长度定量。(D) RT-qPCR 分析Occludin, Claudin-1,和ZO-1表达水平。(E) ,不同组小鼠结肠组织Occludin(绿色)的Claudin-1(黄色)和ZO-1(红色)的荧光图片。不同处理后结肠组织(F) Occludin、(G) Claudin-1、(H) ZO-1荧光定量分析。(I) Control组、Col组、Eug-Col@Fucar组结肠黏膜高度定量分析(n = 4)。(J)不同组胃、小肠、结肠、肝脏组织代表性H&E染色图像。
(8)调节胆汁酸代谢
Col(生物碱)通过影响胆汁酸的代谢,引起了肝脏损伤和胆汁淤积。Col治疗导致胆汁酸的积累,特别是石胆酸(LCA)和牛磺酸鞘磷脂酸钠(TCA)的水平显著增加,这与肝毒性相关。LCA在体内过量时,能够干扰胆汁酸的转运,导致胆汁酸在肝脏中的积累,从而引发肝脏损伤。
然而,Eug-Col@Fucar(由Fucar和Eug组成的复合物)能够部分缓解Col引起的胆汁淤积。Eug-Col@Fucar通过调节胆汁酸相关受体的表达,促进胆汁酸代谢,改善胆汁酸的分泌,减轻肝脏损伤。因此,Eug-Col@Fucar在调节胆汁酸代谢和改善肝功能方面显示出一定的治疗潜力。
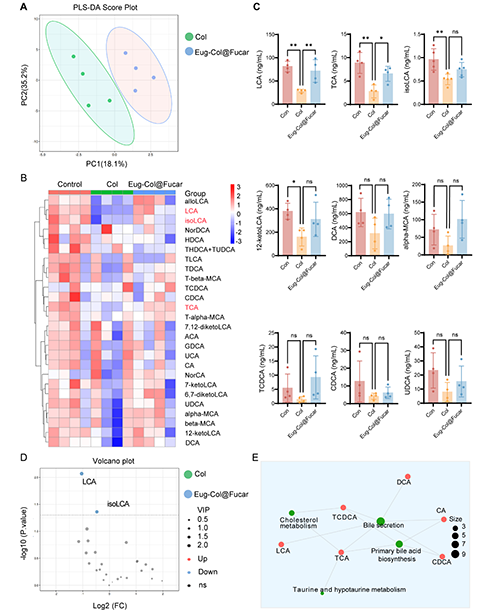 图8. Eug-Col@Fucar恢复胆汁酸代谢物谱。(A) Control组、Col组和Eug-Col@Fucar组的PLS-DA评分图。(B) 不同组胆汁酸相对丰度的群落热图分析。(C) 不同组粪便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的浓度。(D) 火山图反映了Col组和Eug-Col@Fucar组之间代谢物的差异。(E) 对照组、Col组和Eug-Col@Fucar组差异代谢物的KEGG通路富集分析。
图8. Eug-Col@Fucar恢复胆汁酸代谢物谱。(A) Control组、Col组和Eug-Col@Fucar组的PLS-DA评分图。(B) 不同组胆汁酸相对丰度的群落热图分析。(C) 不同组粪便中LCA、TCA、α - mca、isoLCA、12-ketoLCA、DCA、TDCA、CDCA和UDCA的浓度。(D) 火山图反映了Col组和Eug-Col@Fucar组之间代谢物的差异。(E) 对照组、Col组和Eug-Col@Fucar组差异代谢物的KEGG通路富集分析。
(9)调节胆汁酸代谢
通过口服给药Eug、Col、Fucar和Eug-Col@Fucar,并进行血液和组织学分析,研究评估了体内生物相容性。各组的常规血液分析参数均在正常范围内,治疗组与健康对照组之间没有显著差异。然而,Col组在两个肝功能指标(TBA和ALT)上出现了显著差异,特别是TBA含量的增加与胆汁酸代谢分析的结果一致,表明长期使用Col可能导致胆汁酸在肝脏中的积累。此外,心脏、脾脏、肺和肾脏的组织切片中未发现明显的损伤或病理变化。Col组肝脏出现轻度的肝细胞水肿和变性,而其他组的肝脏未见明显病理变化。结果表明,Fucar二元多糖水凝胶能够有效减少Col的长期毒性。
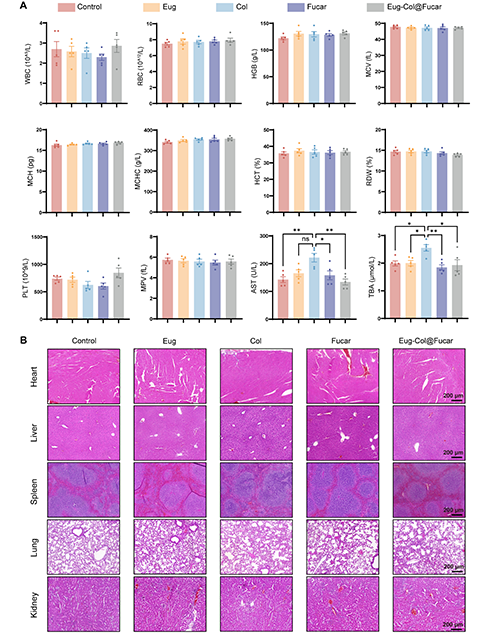 图9. 口服生物安全性评价Eug-Col@Fucar。(A)不同处理后小鼠血常规及生化分析(n = 5)。白细胞(WBC);红细胞;血红蛋白,血红蛋白;MCV,平均细胞体积;MCH,平均红细胞血红蛋白;MCHC,平均红细胞血红蛋白浓度;HCT、血细胞比容;RDW,红细胞分布宽度;PLT:血小板;MPV,平均血小板体积;TBA:总胆汁酸;谷草转氨酶。(B)主要脏器(心、肝、脾、肺、肾)的H&E染色。
图9. 口服生物安全性评价Eug-Col@Fucar。(A)不同处理后小鼠血常规及生化分析(n = 5)。白细胞(WBC);红细胞;血红蛋白,血红蛋白;MCV,平均细胞体积;MCH,平均红细胞血红蛋白;MCHC,平均红细胞血红蛋白浓度;HCT、血细胞比容;RDW,红细胞分布宽度;PLT:血小板;MPV,平均血小板体积;TBA:总胆汁酸;谷草转氨酶。(B)主要脏器(心、肝、脾、肺、肾)的H&E染色。
本研究成功开发了Eug-Col@Fucar水凝胶系统,该系统利用Fucar载载Eug-Col复合物。该水凝胶系统有效减少了细胞毒性,清除自由基和活性氧,促进了细胞向M2型抗炎表型的极化,并抑制了炎症因子的释放。此外,Eug-Col@Fucar水凝胶通过在肠道环境中持续释放药物,显著提高了药物的口服生物利用度。同时,Eug-Col@Fucar通过抑制NLRP3-IL1β途径,稳定并增强了抗炎效果。因此,重编程的抗炎微环境有效抑制了炎症反应,缓解了GA小鼠的踝关节肿胀和关节疼痛。此外,Eug-Col@Fucar有效缓解了Col引起的胃肠副作用,如胃肠组织紧密连接受损和胃绒毛丧失。由于其富含多糖的组成,Eug-Col@Fucar水凝胶系统还改善了胆汁酸代谢,从而减轻了Col引起的肝毒性。除了显著的疗效外,Eug-Col@Fucar还表现出优异的生物安全性,适合长期应用。总之,本研究开发了一种新型水凝胶递送系统,能够增强药物在GA治疗中的疗效,同时减轻Col长期临床应用所带来的不良反应。Eug-Col@Fucar为GA治疗提供了一种有前景的策略,并具有广泛的临床应用潜力。
论文第一作者为浙江大学博士生刘笑阳和浙江大学爱丁堡大学联合学院博士后董佳,浙江大学周民教授为论文的通讯作者。上述研究得到了国家重点研发计划项目、浙江省领军创新创业团队引进计划等基金项目的大力支持。
全文链接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
针对上述问题,浙江大学州民教授团队开发了一种基于开发了一种基于裸藻(Eug)、秋水仙碱(Col)和岩藻糖卡拉胶复合物(Fucar)的口服水凝胶系统(Eug-Col@Fucar) 将裸藻的尿酸吸附特性、岩藻糖卡拉胶复合物的肠道保护功能与秋水仙碱的抗炎作用有机结合。首次实现了"降尿酸-抗炎-消化系统保护"三位一体协同治疗,为痛风患者提供了更安全高效的治疗方案。实验结果表明,Eug-Col@Fucar能有效降低血清尿酸水平,清除自由基和活性氧(ROS),促进巨噬细胞向M2型抗炎表型极化,抑制NLRP3-IL-1β信号通路,从而改善痛风性关节炎。此外,该系统显著缓解了秋水仙碱引起的胃肠道不良反应,如胃肠绒毛结构异常和屏障通透性增加等问题。由于富含多糖成分,该水凝胶系统还能改善胆汁酸代谢,从而减轻秋水仙碱诱导的肝毒性。此外,安全性评估也证实了该复合物的良好生物相容性,为未来临床应用奠定了基础。

该文章近期以《Microalgae-based hydrogel drug delivery system for treatment of gouty arthritis with alleviated colchicine side effects》为题发表于《Bioactive Materials》上。

(1)Eug-Col@Fucar的合成和表征
本研究开发了一种Eug-Col@Fucar水凝胶系统,用于共同传递Eug和Col,制得了更加稳定和均匀的制剂。该水凝胶通过将岩藻糖(Fuc)与不同浓度的卡拉胶(Car)混合,诱导凝胶化。结果表明,随着卡拉胶浓度的增加,水凝胶展现了良好的剪切变稀特性和可注射性,并且凝胶的弹性得到了显著增强。扫描电子显微镜(SEM)图像显示,岩藻糖和卡拉胶通过协同作用形成了致密的凝胶网络,且随着卡拉胶浓度的增加,凝胶孔径减小,从而提高了凝胶的强度和稳定性。Eug-Col复合物成功地被包载进Fucar水凝胶中,并且在加载后水凝胶呈现绿色,显示出优良的可注射性。体外药物释放实验表明,Eug-Col@Fucar能够有效保护Col免受胃酸的降解,允许在小肠中进行控制释放,从而提高了Col的生物利用度并减少了胃肠道毒性。总体来说,Fucar水凝胶系统对于Eug和Col的口服递送是一个有效的载体。

(2)Eug-Col@Fucar的体外生物相容性及抗氧化作用
Eug(一种富含抗氧化成分的微藻)与Col(治疗痛风的临床药物)在Fucar水凝胶载体中协同作用,能够显著增强细胞活力,并减轻Col的细胞毒性。Eug和Fucar显示了良好的生物兼容性,并促进了细胞的增殖。Eug在清除自由基方面表现优异,并与Col一起对抗氧化应激提供保护。此外,Eug-Col@Fucar系统在体外实验中有效地清除了过氧化氢和自由基,且在LPS诱导的氧化应激中显著减少了ROS的生成,表现出较强的抗氧化作用。总体而言,Eug-Col@Fucar不仅具有较强的抗氧化能力,还能够有效减少氧化损伤,具有在治疗炎症性疾病中的应用前景。

(3)Eug-Col@Fucar巨噬细胞重编程和体外抗炎能力的研究
Eug-Col@Fucar系统在治疗痛风性关节炎(GA)中具有潜力。研究表明,Eug-Col@Fucar能够显著诱导小鼠巨噬细胞从M1型(促炎性)转变为M2型(抗炎性),并且通过这种转化有效地抑制了炎症反应。实验中,Eug-Col@Fucar显著提高了M2型巨噬细胞的比例,减少了M1型巨噬细胞的比例,从而降低了与痛风相关的炎症因子(如TNF-α、IL-6、IL-1β)的表达。与Eug、Col、Fucar单独处理相比,Eug-Col@Fucar表现出更强的抗炎作用,能够有效抑制M1型标志基因的表达,并增强M2型标志基因的表达。因此,Eug-Col@Fucar系统能够有效重编程巨噬细胞,转化为抗炎性的M2型巨噬细胞,为痛风性关节炎的治疗提供了一种理想的生物材料。

(4)Eug-Col@Fucar的荧光成像性质及生物分布
Eug-Col@Fucar在口服给药后的生物分布研究表明,该复合材料能够有效延长药物在体内的滞留时间,促进药物的吸收并增强治疗效果。通过荧光成像观察发现,Eug-Col@Fucar主要分布在小肠,尤其是回肠,并且在24小时内,Eug-Col@Fucar在小肠的荧光信号强度和持续时间显著高于自由的Eug和Col。此外,未在主要器官(如心脏、肝脏、脾脏、肺和肾脏)中检测到Eug积聚,说明Eug-Col@Fucar在口服后主要在胃肠道内发挥作用。通过定量分析发现,虽然Fucar涂层使FITC的荧光强度有所降低,但Eug-Col@Fucar组在24小时后的信号更为显著,表明Col的滞留时间得到了延长。冻切片的肠道组织进一步证明了Eug-Col@Fucar能够有效地保持Eug和Col的荧光信号,且与单独使用Eug和Col的组相比,表现出更强的荧光。在降解过程方面,Eug-Col@Fucar在胃肠道内表现出优异的生物降解性。其在小肠和盲肠逐渐解体,到达结肠时几乎完全降解,证明了其良好的生物可降解性。综上所述,Eug-Col@Fucar能够有效延长药物在体内的滞留时间,增强药物吸收,并且具有优异的生物降解性,显示出其作为口服给药系统的潜力。

(5)Eug-Col@Fucar治疗急性痛风性关节炎的疗效
Eug-Col@Fucar在高尿酸血症(HUA)诱导的痛风性关节炎(GA)小鼠模型中表现出了显著的治疗效果。与模型组相比,Eug-Col@Fucar组在减轻关节肿胀、缓解机械性痛觉过敏、改善步态以及减轻骨损伤方面表现更为显著。特别是,Eug-Col@Fucar组在48小时后,关节肿胀程度与对照组相近,远优于单独使用Eug、Col和Fucar的组。此外,Eug-Col@Fucar组的尿酸水平显著低于模型组,而Col组的尿酸水平未能显著降低。Eug-Col@Fucar通过持续释放Eug和Col,有效减轻了由MSU结晶引起的痛风性关节炎的症状,并改善了小鼠的步态障碍。Micro CT分析显示,Eug-Col@Fucar组在关节骨损伤方面明显优于模型组,证明其具有保护骨骼的作用。总的来说,Eug-Col@Fucar不仅能够降低血清尿酸浓度,还能减轻关节炎症、缓解痛感、改善步态障碍,并具有潜力作为治疗痛风性关节炎的双重疗法。

(6)对MSU诱导的氧化应激和NLRP3介导的体内炎症的抑制作用
Eug-Col@Fucar的抗炎效果:Eug-Col@Fucar显著减少了痛风性关节炎(GA)小鼠模型中关节的中性粒细胞和M1型巨噬细胞的数量,表现出强大的抗炎潜力。与模型组相比,Eug-Col@Fucar组在减轻炎症和细胞浸润方面效果显著。Eug-Col@Fucar通过显著减少NLRP3炎症小体的表达,抑制了MSU结晶引起的炎症反应。Western blot分析显示,Eug-Col@Fucar显著降低了NLRP3、活化的Caspase-1、ASC和IL-1β的过度表达,证明其对NLRP3炎症小体的抑制作用。

(7)对秋水仙碱相关不良反应的保护作用
Col的毒性与副作用:Col的治疗剂量接近其毒性剂量,最常见的毒性表现为胃肠道副作用,如恶心、呕吐和腹泻。在GA治疗过程中,Col处理的小鼠体重显著下降,这可能与其毒性相关。Col处理导致胃和肝脏的器官指数显著增加,提示可能引起胃和肝脏组织的病理改变。而在将Col与Fucar共同封装形成Eug-Col@Fucar后,这两者的器官指数恢复正常,表明Eug-Col@Fucar能够减轻Col对胃和肝脏的损伤。Col处理导致结肠长度缩短,并显著减少了紧密连接蛋白Occludin、Claudin-1和ZO-1的表达,表明Col可能损害了肠道屏障功能。而Eug-Col@Fucar能够显著恢复这些紧密连接蛋白的表达,修复肠道屏障功能。Col组的小鼠胃粘膜上皮细胞丧失,结肠组织的杯状细胞分泌减少,导致结肠屏障通透性增加。此外,Col处理还导致肝细胞轻微的颗粒变形和细胞质松弛。通过HE染色可以看到,Col引起的这些胃肠道和肝脏损伤在Eug-Col@Fucar的治疗下得到了明显改善。

(8)调节胆汁酸代谢
Col(生物碱)通过影响胆汁酸的代谢,引起了肝脏损伤和胆汁淤积。Col治疗导致胆汁酸的积累,特别是石胆酸(LCA)和牛磺酸鞘磷脂酸钠(TCA)的水平显著增加,这与肝毒性相关。LCA在体内过量时,能够干扰胆汁酸的转运,导致胆汁酸在肝脏中的积累,从而引发肝脏损伤。
然而,Eug-Col@Fucar(由Fucar和Eug组成的复合物)能够部分缓解Col引起的胆汁淤积。Eug-Col@Fucar通过调节胆汁酸相关受体的表达,促进胆汁酸代谢,改善胆汁酸的分泌,减轻肝脏损伤。因此,Eug-Col@Fucar在调节胆汁酸代谢和改善肝功能方面显示出一定的治疗潜力。

(9)调节胆汁酸代谢
通过口服给药Eug、Col、Fucar和Eug-Col@Fucar,并进行血液和组织学分析,研究评估了体内生物相容性。各组的常规血液分析参数均在正常范围内,治疗组与健康对照组之间没有显著差异。然而,Col组在两个肝功能指标(TBA和ALT)上出现了显著差异,特别是TBA含量的增加与胆汁酸代谢分析的结果一致,表明长期使用Col可能导致胆汁酸在肝脏中的积累。此外,心脏、脾脏、肺和肾脏的组织切片中未发现明显的损伤或病理变化。Col组肝脏出现轻度的肝细胞水肿和变性,而其他组的肝脏未见明显病理变化。结果表明,Fucar二元多糖水凝胶能够有效减少Col的长期毒性。

本研究成功开发了Eug-Col@Fucar水凝胶系统,该系统利用Fucar载载Eug-Col复合物。该水凝胶系统有效减少了细胞毒性,清除自由基和活性氧,促进了细胞向M2型抗炎表型的极化,并抑制了炎症因子的释放。此外,Eug-Col@Fucar水凝胶通过在肠道环境中持续释放药物,显著提高了药物的口服生物利用度。同时,Eug-Col@Fucar通过抑制NLRP3-IL1β途径,稳定并增强了抗炎效果。因此,重编程的抗炎微环境有效抑制了炎症反应,缓解了GA小鼠的踝关节肿胀和关节疼痛。此外,Eug-Col@Fucar有效缓解了Col引起的胃肠副作用,如胃肠组织紧密连接受损和胃绒毛丧失。由于其富含多糖的组成,Eug-Col@Fucar水凝胶系统还改善了胆汁酸代谢,从而减轻了Col引起的肝毒性。除了显著的疗效外,Eug-Col@Fucar还表现出优异的生物安全性,适合长期应用。总之,本研究开发了一种新型水凝胶递送系统,能够增强药物在GA治疗中的疗效,同时减轻Col长期临床应用所带来的不良反应。Eug-Col@Fucar为GA治疗提供了一种有前景的策略,并具有广泛的临床应用潜力。
论文第一作者为浙江大学博士生刘笑阳和浙江大学爱丁堡大学联合学院博士后董佳,浙江大学周民教授为论文的通讯作者。上述研究得到了国家重点研发计划项目、浙江省领军创新创业团队引进计划等基金项目的大力支持。
全文链接:https://www.sciencedirect.com/science/article/pii/S2452199X25002154
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 浙江大学周民教授团队《Nat. Commun.》:基于微藻的肠道绒毛靶向多级生物系统用于肠易激综合征治疗 2025-08-22
- 浙江大学周民教授团队《ACS Nano》:工程化微藻细胞外囊泡通过调控线粒体稳态预防放射性皮炎 2025-07-26
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
