糖尿病伤口受损的电生理微环境可以通过电刺激来修复,但传统笨重的电源阻碍其临床应用。此外,患者对伤口危险状态的感觉障碍和不可见增加了伤口护理的难度和经济负担。为了应对这些挑战,本研究开发了一种基于电磁感应效应自供电的电活性敷料,可实现无线电刺激治疗和伤口微环境监测。该研究通过静电纺丝技术和静电喷雾技术的协同集成,利用Ti3C2Tx MXene和PCL纤维之间形成的纳米互锁结构赋予了敷料优异的机械性能和稳定的导电性(≈3.5 S·cm?1,PBS溶液浸泡7天后保留率为72.2%)。并基于电磁感应效应产生了10.8 μA的无线微电流,成功激活了多种促愈合信号通路(calcium、TGF-β、PI3K-AKT、PPAR、Axon guidance和Wnt),同时抑制炎症相关的信号通路(TNF和NF-κB)。与对照组相比,这种细胞行为和免疫微环境的双重调节分别促进了伤口愈合和神经再生≈36.3%和283.8%。其还可以监测伤口温度、应变和渗出液等生理信号,实现及时和精确的伤口护理。总之,这项研究促进了电磁感应生物医学和个性化医疗的发展。

图1 电活性敷料基于电磁感应促进糖尿病伤口愈合及微环境监测
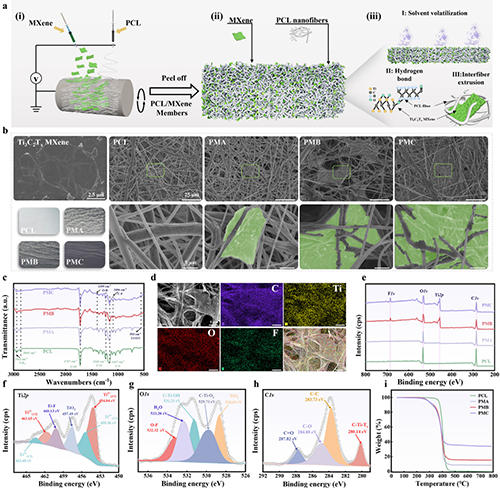
图2 电活性纤维膜的制备与表征
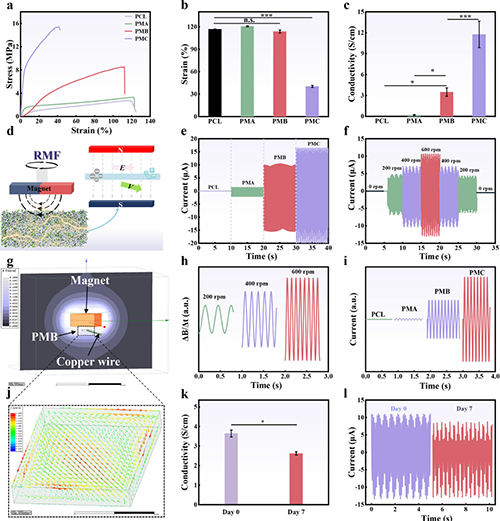
图3 电活性纤维膜的机械性能和无线微电流测试
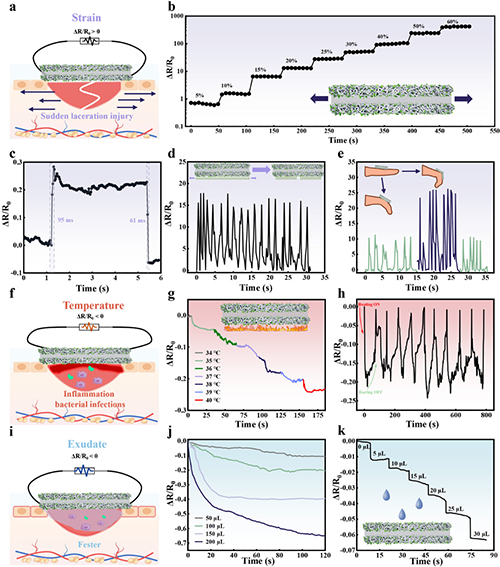
图4 电活性纤维膜的体外诊断监测功能

图5 电活性纤维膜基于电磁感应产生的无线电信号对细胞行为的调控
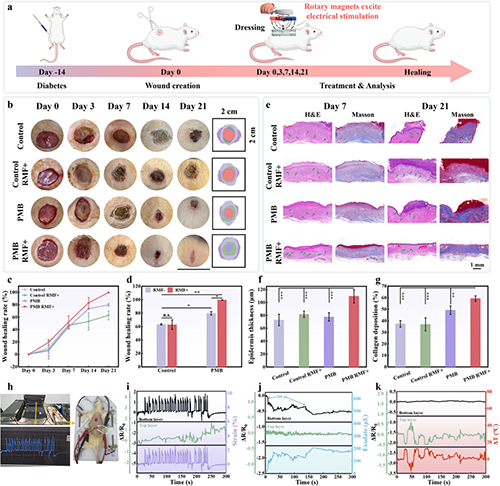
图6 基于电磁感应诱导的无线微电流促进糖尿病伤口快速愈合
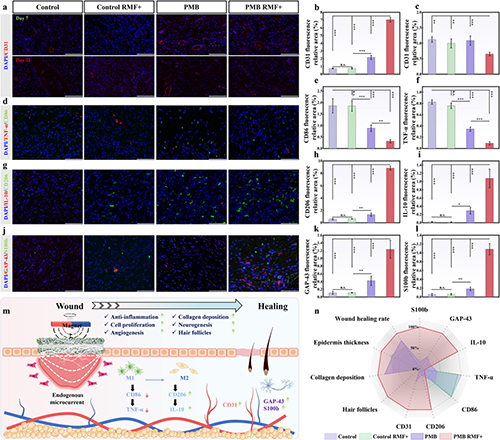
图7 伤口愈合的免疫荧光分析
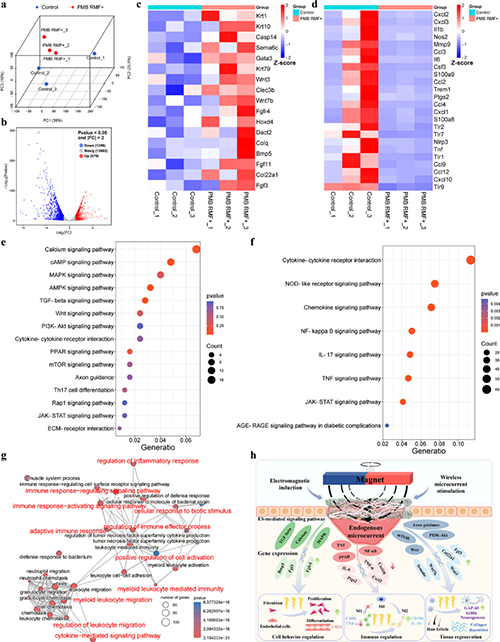
图8 伤口组织RNA序列检测分析
他们成功开发了一种基于电磁感应的无线、自供电、电活性敷料,其有助于糖尿病伤口的快速愈合和功能性皮肤重建,并能够监测伤口微环境变化。Ti3C2Tx MXene与PCL纤维之间形成的纳米互锁结构使敷料具有优异的机械性能和导电性。体内/外研究表明,电活性纤维膜基于电磁感应原理产生的无线微电流有效调控了细胞行为(增殖、迁移和分化)。RNA测序结果证明多种信号通路如钙、TGF-β、PI3K-AKT、PPAR和Wnt被激活,并下调TNF、NF-kappa B和 IL-17 信号通路。这导致相关基因的表达发生变化和细胞因子的释放,从而减轻炎症反应,促进细胞外基质重塑、伤口愈合、神经和毛囊等皮肤附属物的再生。此外,利用电活性纤维膜对温度、应变和渗出液的电阻响应性,成功实现了对伤口微环境生理信号的监测,为智能医疗在提高伤口护理管理的精确性和效率方面的进步做出了重大贡献。该策略拥有便携、无创、无线的优势,并具有监测能力,凸显其在糖尿病患者伤口愈合中的巨大应用潜力。
论文第一作者是东华大学博士生周奉凯,共同通讯作者为东华大学毛吉富研究员和张倩副研究员。
论文信息:
F. Zhou, L. Wei, L. Tang, M. Shan, Z. Wang, J. Peng, Z. Zhang, X. Liu, Q. Zhang, F. Wang, L. Wang, J. Mao, Nano-Interlocking Enhanced Electroactive Dressing: Electromagnetic Induction for Accelerated Diabetic Wound Healing and Wound Microenvironment Monitoring. Adv. Funct. Mater. 2025, e08829.
原文链接:https://doi.org/10.1002/adfm.202508829
