周围神经损伤是临床常见重症,多由创伤、手术并发症等引发,导致运动与感觉功能障碍。但周围神经结构与功能复杂,使其完全修复极具挑战。组织工程支架神经导管的出现为神经修复提供了新路径,然而,严重神经损伤会导致神经细胞代谢紊乱、铁调节蛋白功能异常,使其难以维持铁稳态,进而引发铁过载甚至铁死亡。过量Fe2+池会引发芬顿反应生成大量羟基自由基,诱发过度氧化应激与脂质过氧化,广泛损伤细胞膜和线粒体、破坏能量供应通路,还会引发内质网与线粒体应激,严重阻碍轴突再生。因此,亟需构建能有效调控铁稳态并帮助供能的功能神经导管,以改善神经再生微环境从而加速神经修复。
在本研究中,武汉理工大学戴红莲团队与武汉大学喻爱喜团队合作,提出了一种负载超支化聚柠檬酸(PCA)的微凝胶模块填充型神经导管构建策略,通过协同调控铁稳态、抑制应激反应与强化线粒体能量代谢,实现神经再生微环境的多维度改善。该体系以可紫外光交联的明胶-硫辛酸(Gel-LA)为基质,负载Fe2+螯合剂 PCA,通过微流控技术制备微凝胶模块,再以注射方式注入取向静电纺丝导管(聚(3S-(甲基)-吗啉-2,5-二酮-co-ε-己内酯),P(MMD-CL))中,最终构成 PCA/Gel-LA/P (MMD-CL) 复合神经支架。导管植入体内后,P (MMD-CL) 的取向纳米纤维为细胞提供拓扑引导; Gel-LA 微凝胶的级联孔结构(高比表面积)为细胞提供了大量的黏附位点和生长空间,从而促进细胞浸润与营养传输;释放的PCA 则通过多重机制发挥作用:① 其富含的羧基可高效螯合损伤部位过量 Fe2+,抑制芬顿反应介导的活性氧生成;同时可直接清除 DPPH 与羟基自由基,双重抵御氧化应激;② PCA可上调抗凋亡蛋白 Bcl-2 表达、下调促凋亡蛋白Bax与Caspase-3 活性,缓解内质网与线粒体应激,保护线粒体呼吸链复合体功能,提升细胞能量生成效率;③ PCA 还能激活 HIF-1α/VEGF 信号通路,促进血管内皮细胞迁移与管形成,加速神经血管化进程。这项工作揭示了PCA在周围神经修复中的生物学调控机制,且这种集拓扑引导、铁稳态调控、能量代谢强化于一体的协同体系,突破了传统神经导管微环境调控单一、修复效率有限的技术瓶颈,为周围神经损伤修复提供了新思路,并为更广泛的组织再生工程提供了一种有前景的策略(图1)。
2026年1月1日,该研究成果以“Poly(citric acid) bidirectional regulator: coordinating iron homeostasis to suppress stress responses and boosting mitochondrial bioenergetics for enhanced nerve repair”为题发表在Advanced Materials上(Advanced Materials 2025, DOI: 10.1002/adma.202507931)。武汉理工大学梁馨月博士生和武汉大学中南医院宋语晨硕士生为本论文的共同第一作者,武汉理工大学戴红莲研究员和武汉大学中南医院喻爱喜教授为本论文的共同通讯作者。

图1:生物活性PCA神经支架构建及改善周围神经再生微环境的机制示意图
本研究首先通过Sn (Oct)2催化 MMD 与 ε-CL 开环聚合合成P(MMD-CL),其静电纺丝纤维直径均匀、取向规整,相比 PCL 而言,亲水性与降解性能更优且力学性能适配神经修复。其次,PCA 由甘油与柠檬酸高温聚合形成超支化结构,在水溶液中呈聚集态,兼具浓度依赖性 Fe2+螯合能力与自由基清除活性。Gel-LA则通过明胶接枝硫辛酸制备而成,其微凝胶块经两次光交联形成级联孔结构(300-400 μm 微球、200-300 μm 球间孔、50-100 μm 球内孔),液体渗透率远高于块状水凝胶;Gel-LA/PCA 微凝胶水凝胶流变性能稳定,注入 P (MMD-CL) 导管后可形成结构稳固的复合支架,为神经再生提供物理支撑与生物活性调控(图2)。

图2:生物活性PCA神经支架的合成与表征
经FAS诱导构建雪旺细胞(RSCs)铁过载模型后,PCA处理可显著提升细胞内荧光强度,高效螯合过量Fe2+,并呈浓度依赖性降低ROS水平,逆转GSH含量与GPX4活性的下降趋势;同时上调抗凋亡蛋白Bcl-2与抗氧化酶PON1表达,下调促凋亡蛋白Bax与Caspase-3水平,缓解线粒体膜电位降低,提升线粒体呼吸链复合体Ⅰ、Ⅴ活性及ATP生成量,改善细胞氧耗速率(OCR)相关指标(基础呼吸、最大呼吸、ATP生成),有效保护线粒体功能、抑制细胞凋亡(图3)。

图3: PCA螯合Fe2+并在铁过载的情况下保护线粒体功能
PCA具有显著的促血管生成作用,Transwell 实验证实其能促进人脐静脉内皮细胞(HUVECs)迁移,管形成实验中则显著增加网格数与连接点数;RT-qPCR 结果表明,PCA 可上调血管生成关键基因 CD31、VEGF、HIF-1α 与 SDF-1α 的表达,其机制可能与PCA螯合Fe2+减少 HIF-1α 降解相关,通过激活 HIF-1α/VEGF 信号通路,为神经再生提供充足营养与氧气支持(图4)。

图4:PCA促进血管生成
术后1周的体内实验显示,Hyd_PCA组(负载PCA的微凝胶导管组)较Hyd组(空白微凝胶导管组)显著降低了损伤神经部位TNF-α、NF-κB的表达,有效缓解早期炎症反应;同时下调GRP78、p-PERK等内质网应激标志物,上调Nrf-2表达以减轻氧化损伤,还能抑制Bax活化与Cyt-c释放、上调Bcl-2表达,缓解线粒体应激与细胞凋亡。此外,Hyd_PCA组SOD2、CAT表达虽降低,但HO-1及线粒体DNA修复基因POLG、OGG-1表达升高,进一步证实PCA可协同调控炎症、内质网与线粒体应激,保护神经细胞功能(图5)。

图5: PCA可减轻炎症反应并缓解受损周围神经修复过程中的线粒体和内质网应激
Hyd_PCA组较Hyd组显著上调损伤部位HIF-1α、SDF-1α等血管再生相关蛋白表达,血管网络更规整,证实PCA可有效促进神经血管化。且术后1-4周Hyd_PCA组再生轴突(NF200)生长和雪旺细胞(S100)迁移与成熟速率更快,4周时已实现神经断端对接,显著优于Hyd组(图6)。

图6: PCA促进受损周围神经修复过程中的血管和神经再生
术后1周对大鼠近端神经进行RNA测序结果显示,Hyd_PCA组较Hyd组的差异表达基因涉及抗炎(PPAR、IL-17信号通路)、血管成熟、能量代谢(AMPK、脂肪酸降解通路)及神经再生相关通路,且富集于炎症调控、氧化应激、ATP合成、钙离子结合等过程。PCA可协同上调氧化磷酸化、三羧酸循环关键基因、电子传递链复合物亚基表达及神经活性配体-受体通路标志物基因,揭示PCA通过转录重编程调控多重生物学过程,为神经再生营造有利微环境(图7)。

图7:术后1周对大鼠近端神经残端进行PCA RNA测序以研究炎症反应、血管生成、能量代谢和神经再生早期调控情况
术后12周功能与形态评估显示,Hyd_PCA组大鼠腓肠肌湿重比显著高于Hyd组,肌纤维结构完整、胶原沉积少;神经传导速度、复合肌动作电位振幅及坐骨神经功能指数(SFI)均优于Hyd组,且接近自体移植组。组织学与TEM分析证实,Hyd_PCA组再生轴突直径、髓鞘厚度及有髓轴突密度显著高于Hyd组,雪旺细胞分布均匀,神经结构规整,且炎症与瘢痕组织少,全面验证了PCA复合导管在神经形态修复与功能恢复中的显著成效(图8)。

图8: 术后12周评估神经再生功能
总结:周围神经损伤后瓦勒氏变性引发缺血、炎症及氧化应激微环境,损伤部位Fe2+蓄积通过芬顿反应加剧ROS生成,诱发细胞凋亡、内质网与线粒体应激,阻碍神经再生;而PCA可通过双重作用协同调控该微环境:一方面螯合过量Fe2+并直接清除自由基,减少ROS介导的氧化损伤;另一方面缓解细胞器应激、促进ATP生成、抑制TNF-α等炎症因子表达、上调VEGF/CD31等血管生成相关因子,同时调控凋亡相关蛋白平衡,最终协同促进血管重建与神经再生(图9)。
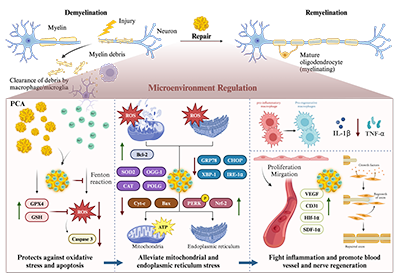
图9: PCA调节周围神经再生微环境机制
论文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adma.202507931
