感染引起的口腔炎症会破坏牙髓和牙周组织,严重时甚至导致牙齿脱落,其发展与炎症因子参与的局部炎症反应密切相关。因此,能否及早发现炎症并及时干预,往往决定了是否会出现不可逆的组织损伤,这也使炎症因子逐渐成为牙科诊断和病情监测的重要指标。然而,在实际临床中,牙科炎症的诊断和预后评估仍缺乏客观、统一的标准。医生多依赖患者主诉、常规检查结果以及个人经验进行判断,这种方式主观性较强,难以准确反映炎症的真实程度,容易出现误判,从而导致治疗不足或过度治疗。虽然酶联免疫吸附测定、聚合酶链式反应等实验室检测方法能够提供较为可靠的定量结果,但操作流程复杂、耗时较长,难以满足牙科临床对快速决策的实际需求。因此,极需发展能够在牙椅旁快速反映炎症状态的检测手段,以更好地服务临床诊疗。
针对这一临床需求,生物传感器通过将体内的生物反应转化为可视化的电信号,在疾病诊断和健康监测中展现出良好的应用前景。然而,将其真正应用于口腔内部仍存在不少现实难题。首先,牙周组织和牙髓渗出液中炎症因子的含量通常极低,对传感器的灵敏度要求非常高;其次,为了准确反映局部炎症状况,传感器需要直接贴附在病变组织或其附近,但口腔内频繁的咀嚼、吞咽和说话等活动,容易造成传感器移位、变形,进而影响信号的稳定性甚至导致检测失败。此外,口腔液体成分复杂,非靶向生物分子容易在传感界面聚集,干扰靶标识别过程,从而降低检测结果的可靠性。
针对上述问题,密歇根州立大学机械工程系林少挺课题组,联合德克萨斯农工大学土木与环境工程系吴承霖课题组,以及密歇根大学(安娜堡)牙科学院 Hajime Sasaki 教授开展了相关研究。
2026年1月16日在《Science Advances》上发表研究论文 “Tissue-adhesive Hydrogel–MXene Biosensor for In Situ Intraoral TNF-α Detection”,报道了一种可用于口腔内原位检测炎症生物标志物 TNF-α 的组织黏附型生物传感平台。该传感器能够稳定贴附于口腔组织表面,在复杂口腔环境中实现对 TNF-α 的灵敏检测,为口腔炎症相关疾病的实时诊断与动态监测提供了新的技术方案。
针对口腔环境中生物标志物含量低、体液成分复杂以及组织持续运动等现实难题,研究团队将石墨烯/MXene 传感探针、具有良好组织黏附性的水凝胶贴片以及选择性渗透水凝胶膜进行整合,构建了一种组织黏附水凝胶–MXene(TAHM)原位生物传感器(图1)。该设计使传感器能够稳定贴附在口腔组织表面,同时有效减少复杂口腔体液对检测信号的干扰,从而显著提升了传感过程的稳定性和可靠性。
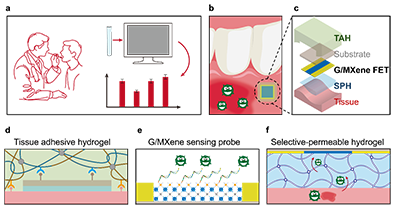
图1. TAHM 生物传感器的介绍。(a)主观医疗判断或繁琐实验室检测流程的示意图。 (b) TAHM 生物传感器的使用场景:黏附于口腔内壁,用于原位炎症因子检测。 (c) TAHM 生物传感器各组成部分的示意图。 (d) 皮肤黏附水凝胶贴片, (e) 基于石墨烯/MXene 的传感探针,和 (f)选择性渗透水凝胶膜的示意图。
通过在石墨烯/MXene 场效晶体管表面固定 TNF-α 适配体,TAHM 生物传感器实现了对 TNF-α 的特异性识别,仅在目标分子存在时产生响应检测限可低至 18.2 fg/mL。在口腔环境中常见的其他非靶向生物标志物,包括链球菌(Sm)、另一种炎症因子(IL-6)以及唾液淀粉酶(sAA)的干扰下,传感器均未出现明显信号变化,表明其具有较高的检测准确性和良好的抗干扰能力(图2)。 虽然该传感器对 TNF-α 具有很高的识别特异性,但在实际检测中,一旦样品中含有较多杂质,非靶向生物分子仍容易附着在传感区域表面,阻碍目标分子与传感器的接触,会明显影响检测结果的可靠性。针对这一问题,我们在传感器表面引入了一层选择性渗透水凝胶膜,利用尺寸筛分效应,使目标生物标志物能够顺利通过,同时将体积较大的干扰分子阻挡在外。实验结果显示,该水凝胶膜可以有效阻止链球菌的渗透。在对比实验中,未使用水凝胶膜时,纯 TNF-α 溶液与含链球菌的混合溶液之间的检测结果相差高达 80.4%;而引入水凝胶膜后,这一差异显著降低至约7 %。上述结果表明,选择性渗透水凝胶膜能够显著减少非特异性干扰,从而提升检测结果的真实性(图3)。最后,针对口腔组织频繁运动带来的干扰信号问题,我们设计了一种柔性、可拉伸的皮肤黏附水凝胶贴片。该贴片不仅能够在湿润的口腔环境中将器件稳定贴附于组织表面,还可借助其良好的可拉伸性分散和缓冲由口腔组织运动产生的外部应力。在不同应变幅度和加载速率条件下,传感信号的波动始终控制在0.5 %以内,且仅在检测到 TNF-α 时才出现明显变化,表明该系统具有优异的机械稳定性和对动态环境的适应能力,能够满足口腔这一复杂、持续运动场景下的应用需求(图4)。
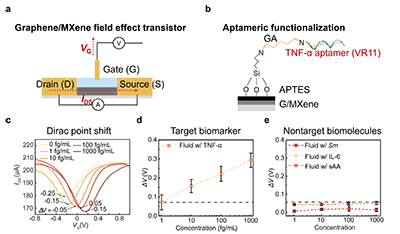
图2. 基于石墨烯/MXene场效应晶体管的 TNF-α 检测。 (a) 场效应晶体管工作原理和(b) TNF-α 适配体 (VR11) 的适配体功能化示的示意图。(c) 不同浓度 TNF-α 条件下的 Dirac 点位移检测结果。 (d) ΔV位移随 TNF-α 浓度变化的定量关系图。 (f) ΔV 位移对不同非靶标生物标志物的响应结果,包括变形链球菌 (Sm)、白细胞介素-6 (IL-6) 及唾液淀粉酶(sAA)。
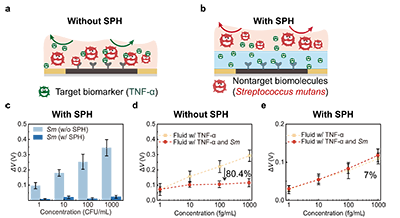
图3. 选择性水凝胶渗透膜 (SPH) 的分子筛分性能。(a) 未引入 SPH 时的检测状态示意图:靶标生物标志物与非靶标生物分子同时吸附于传感贴片表面,产生生物污染 (biofouling),从而影响检测结果的准确性。 (b) 引入 SPH 后的检测状态示意图:SPH 有效阻隔非靶标生物分子,仅允许靶标生物标志物渗透并富集至传感贴片表面,从而提高检测结果的真实性。 (c) 有无 SPH 条件下变形链球菌 (Sm) 检测结果的对比,表明 SPH 能够有效阻隔变形链球菌的干扰。 (d) 无 SPH 条件下,在纯 TNF-α 溶液与混合变形链球菌的 TNF-α 溶液中,ΔV位移随 TNF-α 浓度变化的对比结果,检测信号出现 80.4% 的偏移。 (e) 有 SPH 条件下,在纯 TNF-α 溶液与混合变形链球菌的 TNF-α 溶液中,ΔV位移随 TNF-α 浓度变化的对比结果,检测信号偏移降低至 7%。
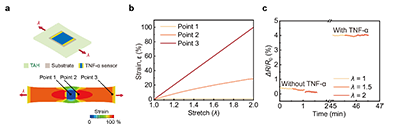
图4. TAHM 生物传感器的应变不敏感特性。(a) 传感贴片附着于可拉伸生物黏附水凝胶上的示意图及其有限元分析结果:分别计算传感贴片(Point 1)、传感贴片邻近区域水凝胶 (Point 2) 以及远端水凝胶区域 (Point 3) 在拉伸条件下的应力分布及其随拉伸率变化的应力响应(b)。(c) 在不同拉伸率条件下有无 TNF-α 时的检测结果对比,表明信号变化主要来源于 TNF-α 浓度变化。
进一步通过系统性的体外、离体及在体实验,研究团队验证了该传感器在真实口腔环境中的可行性和实用性(图5)。实验结果表明,TAHM 生物传感器能够在生理条件复杂、动态变化显著的口腔环境中,实现稳定而准确的原位生物标志物检测。该研究不仅展示了原位口腔生物传感技术在实时炎症监测和疾病早期诊断中的应用潜力,也为面向临床的即时检测平台开发及口腔精准医疗的发展提供了重要的技术基础。
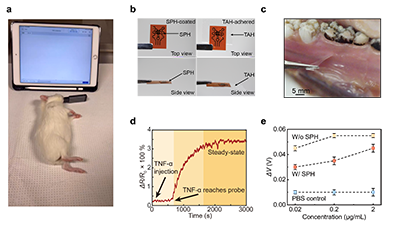
图5. TAHM 生物传感器的动物实验验证。(a) TAHM 生物传感器应用于麻醉天竺鼠口腔内进行 TNF-α 检测的实物照片。 (b) TAHM 生物传感器的实物照片。 (c) 组织黏附水凝胶贴附于猪牙龈表面的实物照片。 (d) TAHM 生物传感器在麻醉天竺鼠口腔内进行 TNF-α 检测时获得的实时信号数据。 (e) 取自麻醉天竺鼠口腔分泌物的离体检测结果,对比了有无SPH条件下的信号变化。
展望
未来,本研究将通过进一步的临床验证,对组织黏附水凝胶–MXene(TAHM)生物传感器在真实口腔诊疗场景中的诊断性能和长期稳定性进行系统评估,并推动其与便携式读出设备的集成,以实现面向实际应用的即时检测系统。同时,通过进一步拓展传感界面的功能化设计,探索对多种炎症相关生物标志物的原位、连续监测能力。依托其在湿润、动态生物界面上的稳定贴附特性和良好检测选择性,该平台有望应用于更广泛的原位生物传感和个性化医疗场景。
论文第一作者为密歇根州立大学博士候选人黄梓鸿和德克萨斯农工大学博士生刘惟佳,两人对本研究贡献相同。其他作者包括密歇根州立大学的马捷、程义杰、卢瑞昊、刘心悦,德克萨斯农工大学的李焦丽、Kent J. Koster、Jeffrey D. Cirillo,以及密歇根大学(安娜堡)的 Hajime Sasaki。
原文链接:https://www.science.org/doi/10.1126/sciadv.ady9180
