皮肤起着感知外界刺激、调节体温、保护身体免受外伤的重要作用,但皮肤也是最容易受损的组织之一。传统的伤口闭合策略通常是具有侵入性的,易导致创伤、组织整合不良和内容物渗漏等问题。因此,开发生物活性无缝线水凝胶敷料非常重要。但是,开发具有湿组织粘附性和快速凝胶过程的可注射、抗溶胀和高强度生物活性水凝胶,以满足快速止血、无缝线伤口闭合和感染皮肤伤口无疤痕修复的要求,仍然面临着持续的挑战。

近期,西安交通大学前沿科学技术研究院郭保林教授和材料学院憨勇教授团队成功制备了一种基于聚(柠檬酸-co-聚乙二醇)-g-多巴胺(PCPD)和负载黄芪甲苷(AS)的氨基封端的Pluronic F127(APF)胶束(AS@APF)的可注射、抗菌和抗氧化水凝胶粘合剂。H2O2/辣根过氧化物酶(HRP)催化氧化体系被用于催化儿茶酚基团之间的氧化偶联以及儿茶酚基团和氨基之间的化学交联以实现水凝胶网络的快速交联。该水凝胶表现出快速的成胶过程、高机械强度、抗溶胀性能、良好的抗氧化性能、H2O2释放行为和可降解性。此外,该水凝胶还具有良好的湿组织粘附性、高爆破压、优异的抗菌活性、AS的长期缓释性等。该水凝胶对小鼠肝脏、大鼠肝脏和兔股静脉出血模型均具有良好的止血效果,并且比生物医用胶和手术缝线实现更好的皮肤切口闭合和愈合。此外,水凝胶敷料通过调节炎症、调节胶原蛋白I/III的比例、改善血管化和肉芽组织的形成,显着促进了MRSA感染的全皮层皮肤缺损伤口的无疤痕修复。总之,该多功能水凝胶敷料具有组织工程和再生医学应用潜力,有望在促进慢性感染伤口修复研究方面提供指导策略。
在这项研究中,作者首先在无催化剂的情况下,通过柠檬酸、聚乙二醇和多巴胺的熔融缩聚反应合成了PCPD预聚物(图1a)。由于PCPD的可水解酯键、柔性聚合物链和丰富的儿茶酚基团,氧化交联的PCPD基水凝胶分别具有良好的生物降解性、高强度以及对各种不同基材的高粘合强度。但是氧化交联的PCPD水凝胶具有高的溶胀率。为了抑制其高溶胀率,作者通过乙二胺(EDA)对PF127进行氨基化修饰,合成了APF作为水凝胶的另一个关键成分(图1a)。H2O2/HRP催化氧化体系具有凝胶时间快且可调、反应过程温和、分解后的过氧化氢不产生有毒产物等优点。因此,使用H2O2/HRP催化氧化体系氧化交联高分子网络制备了一系列可注射水凝胶。在HRP存在下,H2O2产生氧自由基氧化PCPD链上的儿茶酚基团,进一步与其他儿茶酚基团发生氧化偶联或通过席夫碱反应或迈克尔加成反应与APF的氨基交联,形成水凝胶。同时,未反应的儿茶酚基团可以在PCPD聚合物链之间提供氢键。另一方面,APF作为三嵌段两亲性聚合物,可以在水凝胶中自组装成胶束,通过胶束微动力交联的机械耗散机制,降低PCPD的高溶胀性并有效增强水凝胶的机械强度。此外,负载AS的APF胶束可以表现出AS的长期缓释特性。水凝胶可以抵抗压缩和扭曲,并且对不同的组织器官具有良好的粘附性。通过调节水凝胶前体中的H2O2含量用于进一步研究(图1b)。
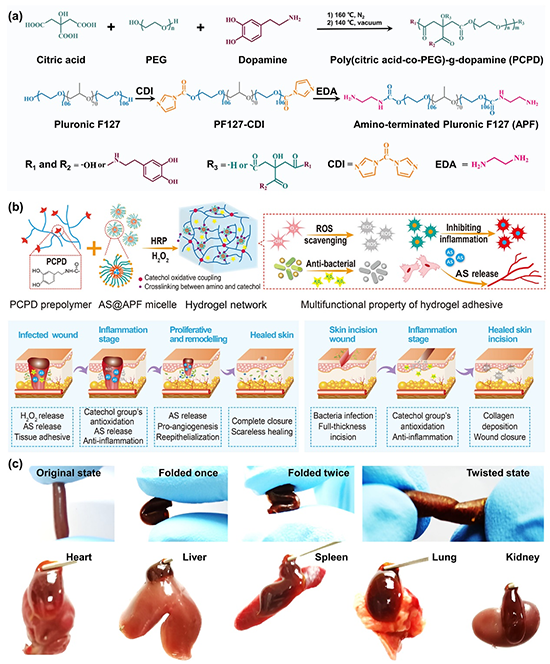
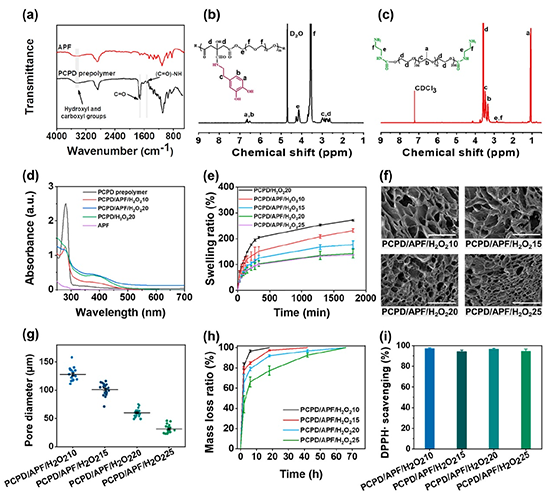
图2:水凝胶的化学结构、溶胀率、微观形貌、降解性能和抗氧化性能表征。
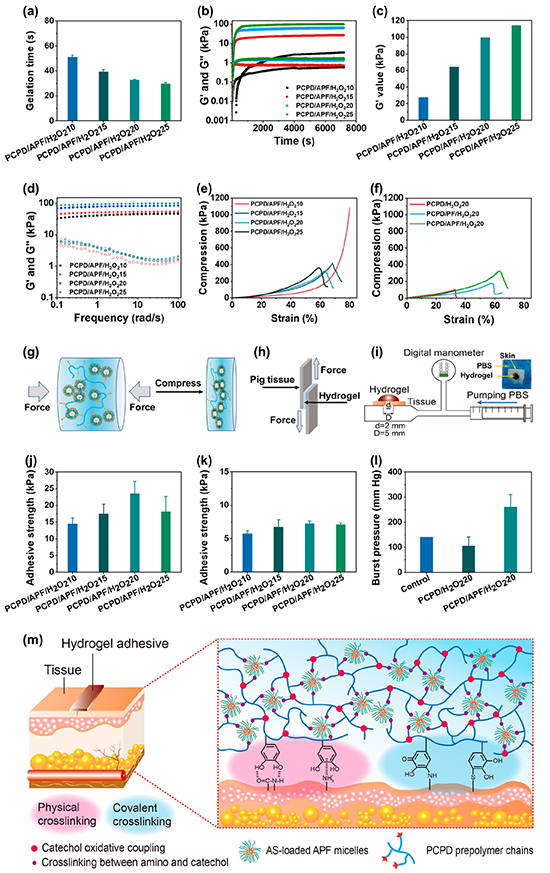
图3:水凝胶的凝胶速率、流变性能、轴向压缩强度、粘附性能和爆破压测试。

图4:水凝胶的生物相容性、抗菌性、过氧化氢释放以及药物释放性能
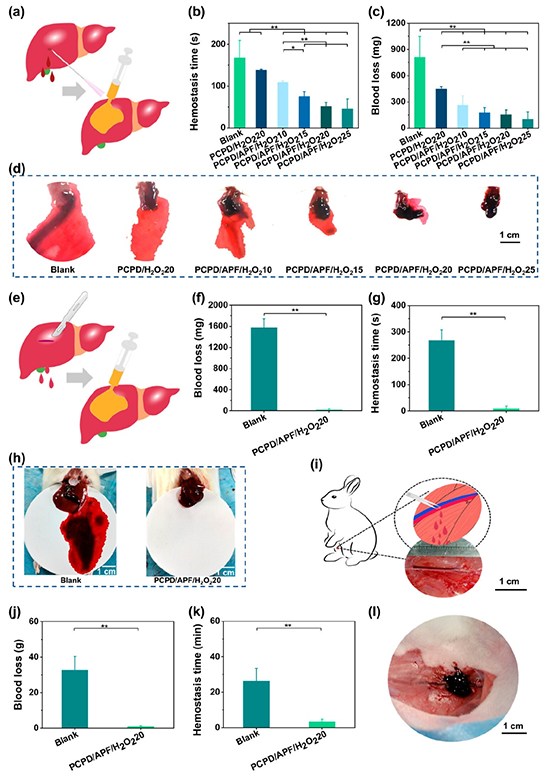
图5:水凝胶的止血性能
通过小鼠肝脏穿刺出血模型、大鼠肝脏切口出血模型和兔股静脉出血模型证明了水凝胶具有优异的止血性能,这得益于水凝胶高的机械强度、湿组织粘附力、爆破压和快的凝胶时间。

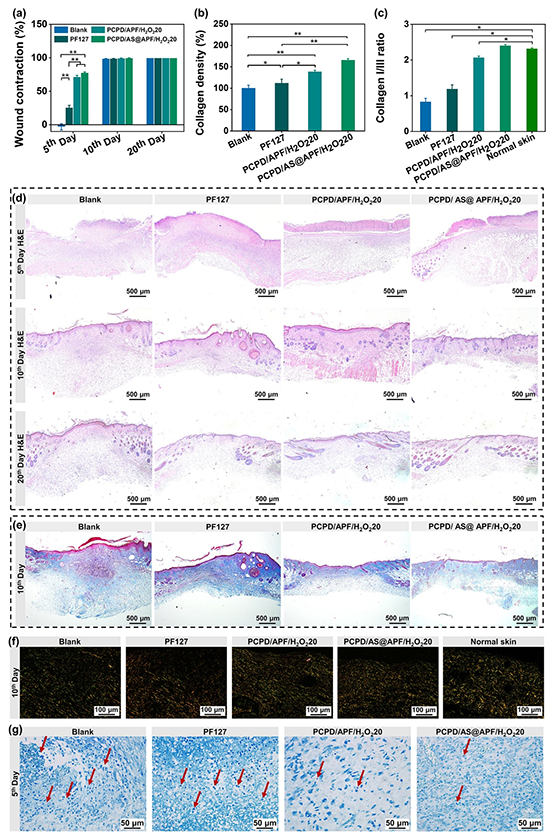

图8:不同治疗后伤口再生组织中TNF-α、IL-10和VEGF的表达水平。
综上所述,该团队基于负载AS的PCPD和APF胶束成功开发了一系列可注射、高强度、抗溶胀的生物活性水凝胶粘合剂,具有快速成胶过程,用于快速止血、无缝线皮肤切口伤口闭合和感染皮肤无疤痕修复等应用。使用H2O2/HRP催化体系交联水凝胶以氧化PCPD/AS@APF混合物,从而在生理条件下诱导PCPD分子间儿茶酚基团的偶联以及PCPD与APF胶束之间的化学交联(席夫碱和迈克尔加成反应)。APF胶束的引入大大降低了水凝胶的溶胀率,并通过胶束的动态机械耗散增强了水凝胶的机械强度。残留的H2O2的释放赋予水凝胶有效的杀菌性能,残留的儿茶酚基团可以清除伤口部位的ROS,以平衡愈合阶段的ROS水平。水凝胶还提供AS的持续释放。体内实验表明,该水凝胶可以通过原位凝胶化快速封闭肝脏和血管出血。此外,水凝胶具有良好的生物降解性和轻微的体内炎症反应。与生物医学胶水和手术缝合线相比,水凝胶实现了更好的皮肤切口伤口愈合。此外,负载AS的水凝胶可以通过调节炎症、改善胶原沉积、促进血管化和肉芽组织形成,显着增强MRSA感染的全层皮肤缺损伤口的无疤痕愈合。因此,这种胶束增强的可注射水凝胶粘合剂可以作为多功能敷料,用于快速止血、无缝线皮肤伤口闭合和耐药细菌感染伤口的无疤修复。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.3c08625
- 西安交大成一龙教授团队 Adv. Mater.:一种用于快速止血、加速组织损伤愈合和生物电子学的高湿组织粘附性抗溶胀水凝胶 2024-12-26
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 四川大学王云兵/张婕妤团队 Adv. Mater.:可注射导电水凝胶贴片通过时空调控实现心肌修复 2025-10-27
- 中山大学付俊/南京林业大学韩景泉 AFM:基于Hofmeister效应的各向异性、抗溶胀导电水凝胶用于水下监测 2025-11-07
- 福州大学赖跃坤教授、黄剑莹教授团队和安徽农业大学朱天雪教授 AFM:突破水下传感瓶颈-多重交联抗溶胀导电水凝胶助力两栖运动监测 2025-07-31
- 天津大学封伟教授团队 Macromolecules:自修复抗溶胀宽温域应用的离子导电水凝胶 2025-06-17
