近日,合肥工业大学生物与医学工程学院纳米医学和生物材料团队一项研究发现,通过光热试剂在近红外光照射下所产生的光热效应,能够触发化疗药物从粘流态高分子纳米药物载体中超敏释放,显著增强对肿瘤生长的抑制效果。该研究成果发表于国际材料学类期刊《先进功能材料》(DOI: 10.1002/adfm.201603195)。
高分子纳米药物载体在肿瘤治疗领域具有广泛的应用前景,第一代高分子纳米药物目前已经在多个国家进行临床试验。然而最新研究发现,高分子纳米药物富集在肿瘤部位并被肿瘤细胞摄取后,需要从纳米载体中快速释放才能达到更有效的肿瘤杀伤效果,目前临床使用的聚乳酸体系高分子纳米药物无法实现这一需求。
该团队开展的“近红外光激发化疗药物从高分子纳米载体可流动内核的超敏释放效应”研究,在前期自主构建的疏水性聚磷酸酯纳米体系基础上,通过包载光热试剂和化疗药物阿霉素得到共负载纳米体系,其内核高分子材料玻璃化转变温度低至-81.8 °C。在近红外光照射5秒后,纳米颗粒溶液温度微弱上升0.5~1.5°C,并触发化疗药物的快超敏释放。实验结果表明,在肿瘤部位化疗药物富集基本相当的情况下,近红外光触发的化疗药物超敏释放,能显著增强抑制肿瘤生长。32天治疗结束后,聚磷酸酯纳米载体实验组小鼠肿瘤体积仅为聚乳酸纳米实验组的三分之一。
对这两种体系的荧光分子寿命检测结果表明,在光热效应下,触发药物分子和聚磷酸酯链段速度加剧,导致药物快速释放;近红外光照射停止后,化疗药物的释放速度极剧降低。而在目前临床上使用的第一代聚乳酸高分子纳米药物中,由于聚乳酸的玻璃化转变温度高达40.2 °C,在光热转化时聚乳酸链段仍处于玻璃态,整个高分子链不能运动,从而导致化疗药物运动被阻止,这种超敏释放效应并未观察到。
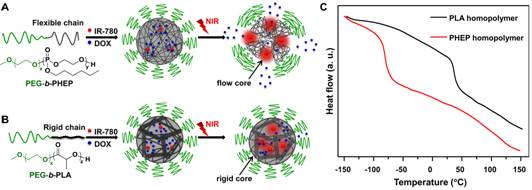
图一、药物从(A)聚磷酸酯和(B)聚乳酸纳米颗粒的近红外光超敏响应性释放示意图;(C)聚磷酸酯和聚乳酸的DSC曲线。
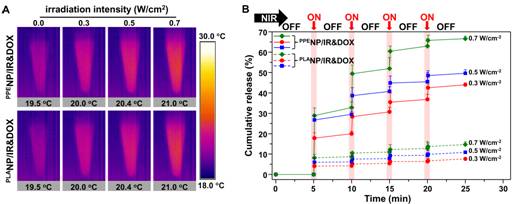
图二、(A)共负载IR-780和DOX聚磷酸酯和聚乳酸纳米颗粒的光热效应;(B)近红外光触发DOX从聚磷酸酯和聚乳酸纳米颗粒释放行为。
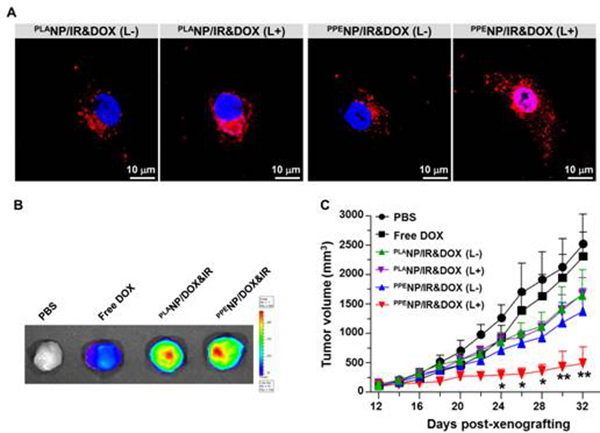
图三、(A)近红外光照射下,DOX胞内聚磷酸酯和聚乳酸纳米颗粒的释放效应;(B)聚磷酸酯和聚乳酸纳米颗粒载肿瘤组织的富集;(C)近红外光照射下,共负载IR-780和DOX聚磷酸酯和聚乳酸纳米颗粒对肿瘤生长的抑制曲线。
这一研究成果为抗肿瘤高分子纳米药物载体的设计提供了有价值的参考。该团队还将进一步研发设计光调控的纳米药物载体,结合无机、脂质以及高分子等材料的研究,以期对肿瘤进行更有效的治疗。
据介绍,该项成果的第一作者王俊侠是合肥工业大学生物与医学工程学院的硕士研究生,在该院纳米医学和生物材料团队以及中国科学技术大学实验组完成。该同学一直从事聚磷酸酯纳米体系用于肿瘤治疗的研究工作。目前以共同第一作者在ACS Applied Materials Interfaces(IF 7.145)发表论文3篇,以第一作者身份在Advanced Functional Materials(IF 11.382)发表论文1篇。合肥工业生物与医学工程学院纳米医学和生物材料团队目前由钱海生教授、杨显珠教授、查正保教授、王峰教授等人组成,团队重点关注纳米载体与细胞相互作用的调控、纳米体系用于肿瘤的成像诊断、治疗等方面的研究。
- 中国海洋大学徐晓峰教授团队 AFM:吸湿复合材料同轴3D打印 2026-02-26
- 武汉纺织大学教育部重点实验室王栋教授团队招聘博士后和青年教师 - 纺织材料、高分子材料、过滤分离材料、多孔膜材料 2026-02-24
- 北大裴坚团队、张文彬团队《Adv. Mater.》:调控溶液态聚集实现共轭高分子的剪切诱导取向与高迁移率电荷传输 2026-02-24
- 四川大学何斌/蒲雨吉 ACS Nano:高分子化丁酸纳米平台治疗肠炎 2023-12-24
- 华南理工朱伟 Adv. Sci.:基于红细胞和MOF-级联酶的人工生物杂化体用于高尿酸血症治疗 2023-12-17
- 长期有效 | 西南交大周绍兵教授团队诚招博士、推免硕士 - 材料、生物医学工程 2023-09-23
