肌腱通过纤维软骨界面(enthesis)插入骨骼,以减少机械张力和组织衰竭。尽管有这种增韧机制,但撕裂也会因为急性(超载)或降解(老化)过程而发生。而手术将撕裂的肌腱固定到骨中,会导致具有较低生物力学性能的瘢痕组织界面的形成。来自美国伊利诺大学厄巴纳-香槟分校的Brendan A.C. Harley等人报道了一种创新的组织加固策略:包含骨性和腱性组织隔层的层状支架,通过连续的聚乙二醇(PEG)水凝胶界面连接。调整水凝胶的凝胶动力学可以调节与侧翼间室的整合,并产生生物力学性能优势。值得注意的是,在传统的分层生物材料中,水凝胶界面减少了组织隔层间菌株浓度的形成,这可能会产生有害的生物效应。这种机械坚固的分层复合生物材料的设计可能适用于广泛的肌腱和韧带-骨插入。相关论文以题为“Tough and tunable scaffold-hydrogel composite biomaterial for soft-to-hard musculoskeletal tissue interfaces”发表在Science Advances上。
1.背景介绍
尾端是一种分层的纤维软骨组织(250-500 μm宽),包含细胞表型、生化信号、矿物质含量、基质成分和结构排列的梯度,从而提供一个过渡区,通过该过渡区肌腱连接到骨骼。这种独特的界面组织微环境通过提供一个持续的高顺应性的能量吸收区,促进了功能承载,这是拉伸载荷下组织增韧的一个重要机制。典型的尾端损伤是肩袖撕裂,急性超负荷、随年龄增长的退化或两者的结合导致肌腱到骨骼的局部或全宽度撕裂。肌腱再附着是临床标准,但会导致狭窄的纤维血管瘢痕组织的形成,而不是一个梯度的纤维软骨结束。在机械不匹配的肌腱和骨骼之间形成的锐边界导致了应变浓度,这大大增加了再次失败的风险(在一些老年人口中为90%)。撕裂组织的功能性恢复需要纤维软骨顺应性界面的再生;然而,由于缺乏能够满足这些组织独特功能需求的生物材料设计,再生修复策略的进展受到阻碍。
分层生物材料为尾端的修复提供了潜在的优势。这些生物材料可以选择性地呈现具有成分、结构和力学特征的优化信号模式,这些特征在离散区域内定制,以在空间上调节细胞生物活性和组织重塑。为此,研究者最近描述了一种冻干方法来制造含有腱(各向异性)和骨(矿化)腔室的双相胶原支架,这些腔室具有不同的组成和结构,通过连续的界面连接。然而,这种双相支架和大多数用于肌腱-骨结合修复的生物材料将肌腱-骨结合复制为肌腱和骨之间的梯度过渡,而不是一个独特的多尺度组织。虽然在肌腱和骨修复的生物材料已经取得了显著的进展,但在生物材料中组织间的固有力学不匹配,可能在生物学和力学上对肌腱的修复是有害的。肌肉负荷是肌腱、骨和肌腱的发育和维持所必需的,也是损伤和修复后不可避免的。在这项研究中,研究者表明,在承受力矩驱动的拉伸载荷时,人类的肩膀在肌腱-骨骼插入处有可能产生大量的应变浓度,这一特性取决于肩膀的整体刚度。在受载的分层充填生物材料中,在不同的腱和骨区域之间的界面上的力学不匹配同样会导致应变集中,这会大大降低细胞存活率并成为可能的骨折点。因此,由此产生的界面应变导致细胞反应减弱,在需要再生的精确位置导致移植物失败。
在这里,研究者报告了一种独特的生物材料增强基序的发展和验证,其灵感来自于原生尾端的结构-功能特性:在力学上不匹配的腱组织和骨组织间包含一个兼容的水凝胶界面。虽然这些设计元素在工程材料中很常见,但在组织工程生物材料中还没有被探索过。研究者已经开发了一种方法来控制在腱和骨间的柔性聚乙二醇(PEG)水凝胶带的插入和稳定之前描述的双相胶原支架。由此产生的三相生物材料不同于缺乏连续界面的分层两相或三相生物材料。研究表明,调整该水凝胶区制造参数提供了一种稳健的方法,以降低在双材料界面不匹配时形成的应变浓度水平。水凝胶嵌入也显著提高了整个组织支架的宏观力学性能,并为组织工程方法提供了一种新的设计范式,以改善广泛的肌肉骨骼组织插入的愈合。
2.材料与方法
2.1 水凝胶稳定地集成不同的组织支架隔层
研究者使用辣根过氧化物酶介导的化学聚合,将四臂PEG-硫醇单体共价交联到界面水凝胶网络中(图1A)。这里,tcross定义的是从主要粘性(G′ < G′′)到弹性(G′ > G′′)材料的转换时间,而平衡存储模量(G′eq)是材料弹性响应的量度。研究者从之前鉴定过的凝胶库中选择了一组PEG-SH水凝胶,以匹配冻干支架制造的时间范围(t:0~60分钟),并具有一系列弹性行为(G′eq: 4 to 15 kPa)(表1)。
表1 以前报告的SAOS测量中识别的水凝胶样品一系列的测试集参数tcross, Δtgel和G′eq。
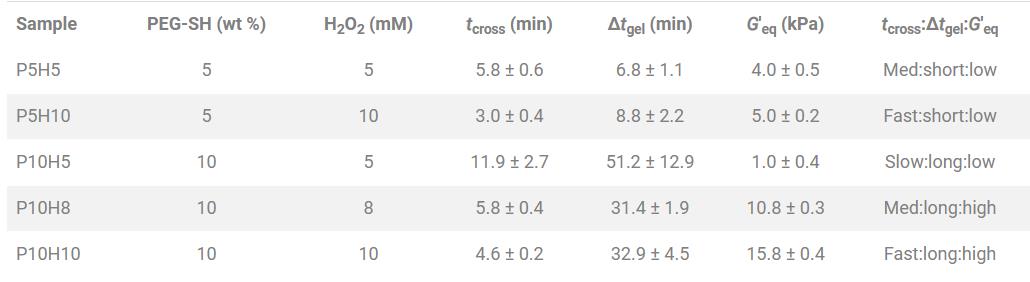
图1 PEG水凝胶的交联反应与三相支架的制备。
为了制造连续的三相支架,研究者采用了一种铜聚四氟乙烯(PFTE)模具,该模具允许水平装载液体悬浮液,以便在冻干之前进行精确的分层和控制相扩散(图1B)。经冻干后,在结构上形成了连接腱和骨支架间的PEG水凝胶界面层的连续三相支架(图1C)。在模具一端,铜和PFTE之间的导热系数不匹配建立了局部定向凝固,诱导形成各向异性的非矿化(腱状)支架腔,而在模具另一端,形成了各向同性矿化(骨)胶原支架结构。
2.2 界面水凝胶的整合和拓扑结构取决于凝胶动力学
环境扫描电子显微镜(ESEM)的三相支架图像表明,可以通过改变水凝胶的凝胶化性能来调整水凝胶界面的拓扑结构和掺入程度。总体而言,凝胶化速度快的水凝胶(快的tcross和短的Δtgel)更均匀地以明显的单片水凝胶层混入支架中,而凝胶化速度慢的水凝胶则分布在两侧组织隔室的胶原纤维中(图2A),可能是由于水凝胶和胶原悬浮液之间扩展的扩散混合。支架与水凝胶界面的宽度也可以通过凝胶化来控制(图2B),从而可以根据不同的水凝胶化特性制备具有独特界面区的三相支架。水凝胶界面分为快速(3~4分钟)、中等(6分钟)和慢速(12分钟) tcross;短(7-9分钟)或长(31-51分钟)Δtgel; 以及低(1-5 kPa)或高(10-15 kPa) G′eq。在这里,三相支架是通过这些独特的凝胶化参数(tcross:Δtgel:G′eq)来识别的,这些参数描述了从粘弹性转变的时间(tcross),完成凝胶化的时间(Δtgel),以及水凝胶界面的最终弹性特性(G′eq)。
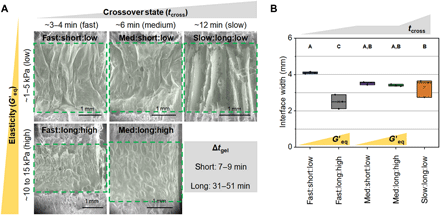
图2 界面水凝胶的拓扑结构和宽度。
2.3 界面水凝胶可以调节支架对拉伸载荷的响应
研究表明,在单轴拉伸条件下,凝胶依赖于掺入柔性水凝胶层是一种有效的骨架增韧机制。与缺乏水凝胶插入的双相支架相比,含有快速凝胶(tcross)水凝胶配方(快速:长:高、快速:慢:低)的三相支架的大块支架韧性显著提高(图3A)。韧性似乎不受总凝胶化时间 (Δtgel) 或水凝胶相弹性性能(G′eq)的强烈影响。快速胶凝合成的变体也比其他慢 tcross 交联的变体显示出明显更高的韧性,这表明在该制造方案中,需要一个特定的凝胶时间尺度纳入到增韧界面水凝胶中。
快速tcross水凝胶增加韧性的机理是不同的(图3B)。水凝胶长的Δtgel和高G′eq显著提高了极限抗拉强度(图3C)和三相的支架的弹性模量(图3E),从而形成了更高的应力-应变曲线以及最大承受应力也随之增加。相对地,具有短的Δtgel和低的G′eq(快:短:低)的水凝胶显著增加了骨折前的应变耐受性(图3D),弹性模量明显降低,从而形成更具延展性的三相支架。这些不同的增韧机制在应用生理压力下是显而易见的(图3F-G)。在最大施加应变为3%时,由于相对较低的压力级别,更加延展快:短:低的变体比更高刚度快:长:高的变体明显表现出较低的柔韧性。
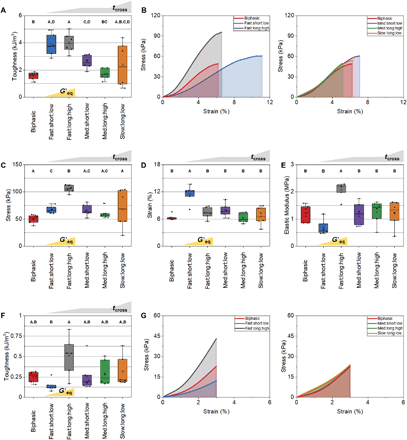
图3 块状支架在单轴拉伸下的力学性能。
2.4 水凝胶可以消除力学上完全不同组织隔层之间的界面张力
为了便于实验组之间的比较(图4),所有支架的应变分布均使用相同的标度进行报道,并使用个性化标度来更准确地显示实验组内的应变。在3.3%的块状实施应变下,双相支架在腱组织和骨性组织间的界面处出现了一个巨大的应变(~10%),这是最终在3.5%的块状实施应变下的断裂点(图4A)。与双相支架相比,三相支架没有显著增加韧性,在生物材料界面上显示出相似的应变浓度。然而,高韧性的三相变体在界面处显示出明显的应变降低,而在弹性更强的腱区则显示出明显的应变升高,在那里它们最终在8.7和7.4%的施放应变下断裂。随后,研究者仅在腱组织和骨组织间的过渡区检查了应变剖面,获得了更清晰的界面应变表征(图4B)。在3.3%的体应变作用下,两相支架界面出现了比整体应变大7.2%的急剧应变浓度,而高韧性的三相支架界面出现了均匀分布的应变(~2%),小于整体的体应变作用。此外,三相支架在横向上的界面应变变异性比双相支架低,说明界面水凝胶在其宽度上具有更均匀的应变。
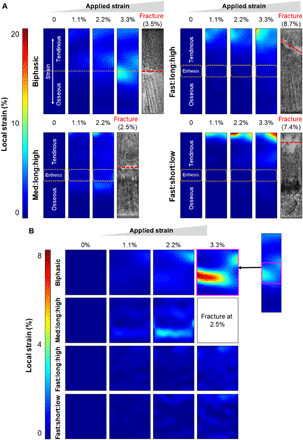
图4 在单轴拉伸下,支架的局部应变分布
2.5 人的肩膀在局部组织应变中表现出僵硬依赖的变化
研究者检查了尸体捐献者冈上肌腱和肩包膜的应变分布。冈上肌腱被固定在一个测试仪器上,并施加扭矩载荷,导致在局部组织水平上的肌腱到骨骼的拉力载荷。在一个高刚度的试样中,拉伸加载导致接近尾声的应变集中可以忽略不计。然而,在较低刚度的试样中,拉伸加载导致约14%的应变集中在尾端或靠近尾端。
4.结论与展望
在此,研究者演示了一种以前未确认的坚韧的、分层的生物材料,用于修复尾端创伤的制造和验证。在不同的胶原蛋白支架之间加入一个顺从的水凝胶界面,提供了一种生物激发增强方法,以有效地分散不同生物材料环境之间的局部应变,并减少界面失效的发生。这个坚韧复合生物材料的模型可以为分层复合材料的生物激发增韧和一系列骨科插入损伤的坚固组织支架的设计提供新见解。
参考文献:Sun Han Chang et al., Sci. Adv. 2020; 6 DOI:10.1126/sciadv.abb6763
原文链接:https://advances.sciencemag.org/content/6/34/eabb6763
下载:原文
- 四川大学孙静/范红松团队 ACS Nano:兼顾抗菌活性与细胞保护功能的类酶水凝胶用于细菌性角膜炎中的角膜再生 2026-03-05
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- 浙江大学高长有团队 Prog. Mater. Sci.:用于组织修复的自适应性生物材料 2025-11-30
- 武汉理工戴红莲课题组 Coordin. Chem. Rev.:苯硼酸生物材料 - 从化学原理到材料设计 2025-09-23
- 北京大学邵元龙《Adv. Mater.》综述:用于组织电子设备接口的生物材料基纤维状植入式探针 2025-06-27
