在过去的几十年中,人们一直致力于探索各种有效的临床药物筛选方法,以明确证明各种化学治疗药物的药理学和毒理学特性。基于细胞单层的传统二维(2D)细胞培养方法已得到广泛应用,虽然操作简单,但在模拟高度复杂的细胞外基质(ECM)微环境时具有一定的局限性,无法准确反映体内细胞-细胞以及细胞-环境间的相互作用。为了克服这些局限性并得到能够高度模拟体内肿瘤特征的组织替代物,基于细胞聚集体的三维(3D)肿瘤模型已成为一种有前景的替代方法。
华侨大学陈爱政教授课题组和哈佛医学院Y. Shrike Zhang教授课题组基于聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)多孔微球成功构建三维肝癌模型,并研究该疾病模型在药物筛选方面的应用(图1)。首先,利用微流体技术制造了PLGA的大多孔微球(PLGA PMs)。通过微流控技术制备的PLGA PMs平均粒径为395 μm,拥有开放且相互贯通的孔洞,孔径为10-60 μm。然后,使用动态培养方法,通过在PLGA PMs中填充人肝癌细胞(HepG2)和人脐静脉内皮细胞(HUVECs),探索细胞组织聚集体的形成条件及肿瘤微组织的形成过程,构建3D肝癌肿瘤微组织模型。结果发现,在共培养5天后,分散性良好的微球之间开始聚集,并在后续培养过程中形成组织团块。最后,利用该疾病模型用于评估各种化学治疗抗癌药,包括对于阿霉素(DOX)和顺铂(CIS)的细胞反应。在相同培养时间下,细胞在3D培养条件下的IC50值与传统的2D培养条件相比明显更高,且结果具有显著性差异,说明3D培养下的细胞具有更好的抗药性,构建的肿瘤模型更加接近真实的肿瘤组织。
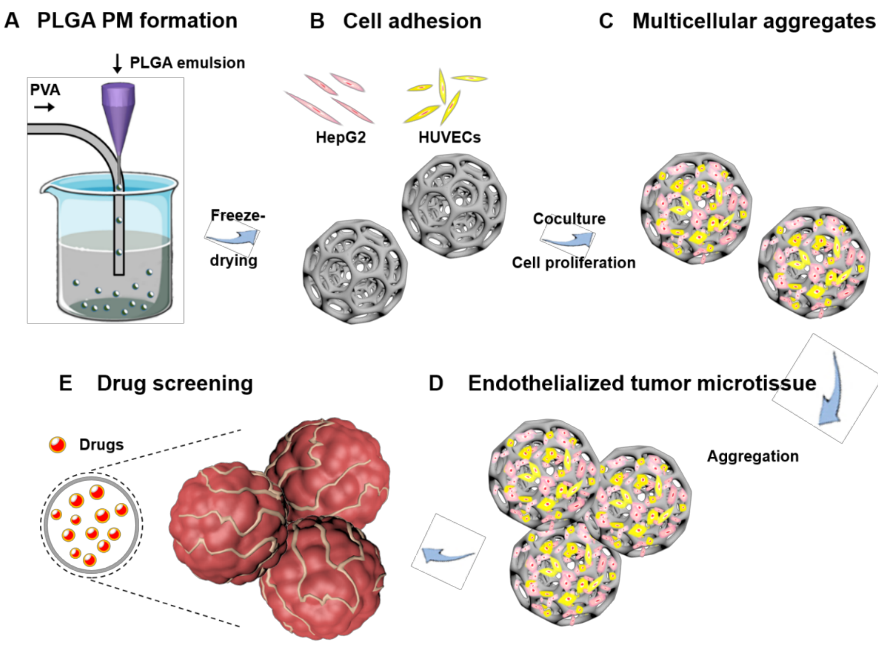
图1 研究示意图。
为进一步探究PLGA大多孔微球与HUVECs和HepG2细胞的相互作用以及肝癌组织的形成过程,将获得的多孔微球混以HepG2和HUVECs,在动态培养条件下观察细胞的粘附情况及单分散性良好的微球之间因细胞相互作用而出现的微球间聚集及肝癌组织形成情况(图2)。

图2 血管化肝癌组织模型形成过程。黄色荧光标记为HUVECs,紫色荧光标记为HepG2。
荧光染色结果表明,在共培养第一天时,细胞主要粘附在微球表面,内部孔洞结构分布了少量细胞。当培养到第2天时,微球内部的荧光强度明显增强,表明细胞此时已经进入微球内部,并保持着良好的活性。尤其是在第3天时,单分散性良好的微球由于细胞间的相互作用开始靠近,形成“细胞桥梁”。在第5天时形成聚集体,细胞核染色结果进一步验证了该实验结果(图3)。另外,相比于2D培养条件下的HUVECs和HepG2,3D动态培养条件下的血管化肝癌模型中的细胞能够分泌更多的白蛋白(Albumin)和多药耐药蛋白(MRP),说明了组织形成及抗药能力提升潜在的可能性。
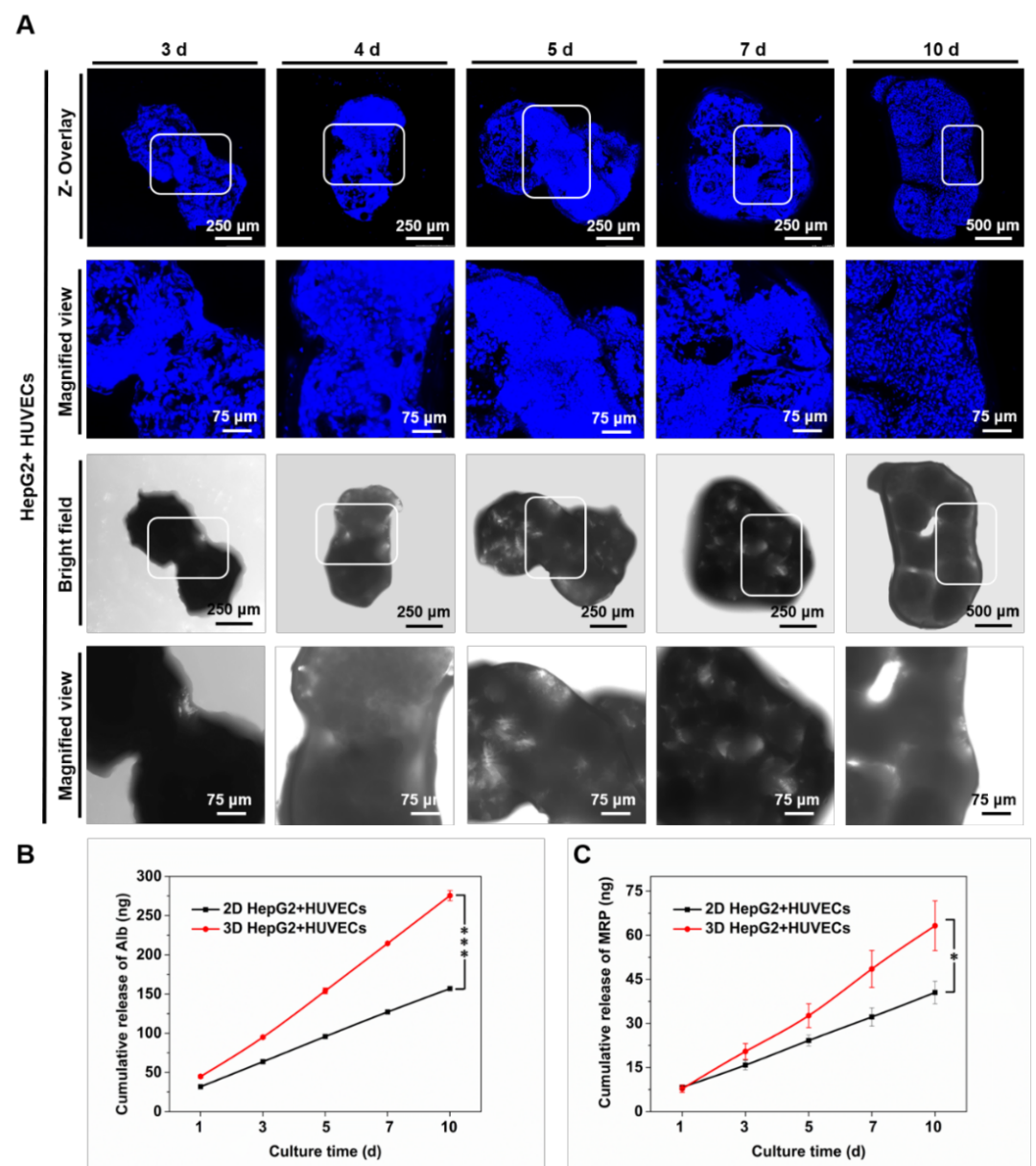
图3 (A)血管化肝癌组织模型形成过程及组织分泌(B)Albumin和(C)MRP分析。
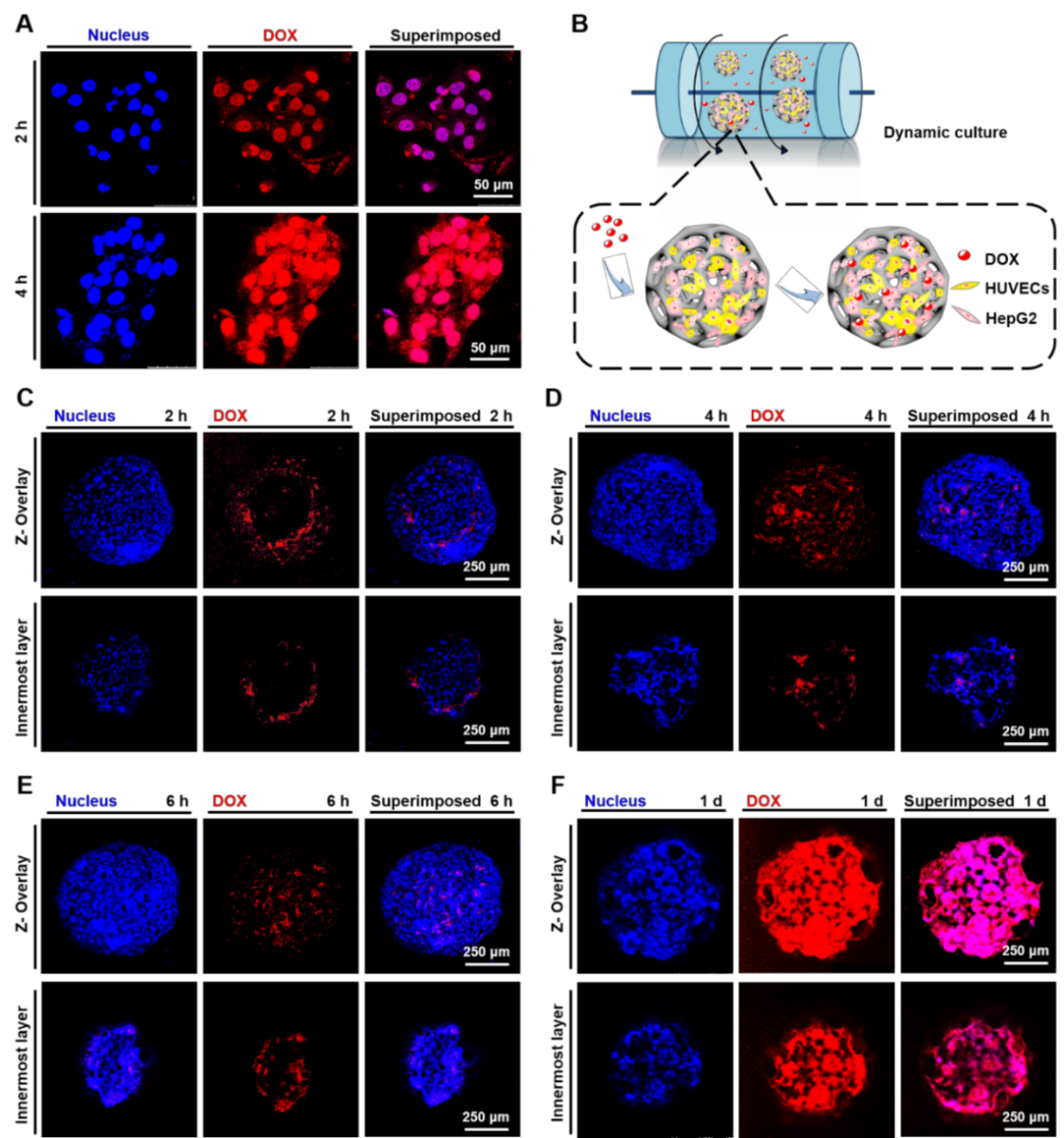
图4 DOX(红色荧光)作用于(A)2D培养的细胞,及(B)动态培养条件下,(C-F)DOX作用于血管化肝癌组织模型不同时间药物的积累情况分析
以DOX为模型药物,作者观察了不同时间DOX在血管化肝癌模型中的积累情况(图4)。由图4A可以看出,在2D培养条件下,DOX在4 h时即可聚集在细胞内部。而对于3D动态培养条件下的血管化肝癌模型(图4B-F),在6 h时只能观察到少量的红色荧光,在继续作用1 d后,DOX才逐渐进入组织内部。说明利用PLGA PMs构建的3D血管化肝癌模型能够有效地延长药物进入细胞的时间。另外,细胞活性分析结果表明,在相同培养时间下,细胞在3D培养条件下的IC50值明显更高,且结果具有显著性差异,说明3D培养下的细胞具有更好的抗药性,构建的肿瘤模型更加接近真实的肿瘤组织。利用另一种模型药物CIS重复上述实验,能够得到类似的实验结果,说明了该肝癌模型对于药物筛选研究的普适性。综上所述,以肝癌模型为例,可以通过同时负载HepG2及HUVECs体外培养形成血管化的肝癌组织,有利于构建具有复杂血管网络、高度仿生的肝癌模型,与2D培养相比,可明显提升细胞对DOX、CIS的抗药性。该血管化肝癌模型将可用于更多的抗肿瘤药物的筛选研究。
以上相关成果以“Modeling Endothelialized Hepatic Tumor Microtissues for Drug Screening”为题,近期在线发表于《Advanced Science》。论文通讯作者为华侨大学陈爱政教授和哈佛医学院Y. Shrike Zhang教授,华侨大学17级博士生王颖和Ranjith Kumar Kankala博士为共同第一作者。华侨大学王士斌教授、张建庭博士、郝浏智硕士和复旦大学中山医院朱铠博士为论文的共同作者。
华侨大学部分的研究工作得到国家重点研发计划重点专项(2018YFB1105600)、国家自然科学基金海峡联合重点项目(U1605225)及福建省生物材料科技创新团队项目的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202002002
作者简介
陈爱政:博士、教授、博士生导师。
福建省优秀教师,入选国家百千万人才工程、被授予“有突出贡献中青年专家”荣誉称号。目前担任中国生物材料学会理事、中国生物材料学会复合材料分会秘书长、中国生物材料学会青年委员会委员、华侨大学生物材料与组织工程研究所所长、福建省生物材料科技创新团队带头人、福建省生物材料化工博士生导师团队带头人。主持国家自然科学基金海峡联合重点项目、面上项目、国家重点研发计划重点专项子任务等国家级课题7项,及教育部博士点基金等省部级和其他课题累计10余项。主要从事超临界流体技术及生物材料与组织工程领域的研究,已在AM, AFM, Small, JCR, CEJ, AHM, Biofabrication等期刊发表SCI收录论文100余篇,获授权国家发明专利10余项。
课题组网页:https://www.x-mol.com/groups/hqubiomat
Y. Shrike Zhang:博士,美国哈佛大学医学院助理教授,2013年于Georgia Institute of Technology生物医学工程系取得博士学位。研究领域包括生物打印及器官芯片的平台搭建与应用研究,在相关领域发表研究论文及综述200余篇,包括以第一或通讯作者发表的PNAS、Science、Nat. Rev. Mater.、Nat. Commun.、Adv. Mater.、ACS Nano、Angew. Chem. Int. Ed.、Biomaterials 等,其中超过40篇封面文章;研究成果曾被BBC、Fox News、The Boston Globe/STAT News、Science Daily、Technology Networks、IEEE Spectrum、C&EN、《科技日报》等报道。担任十余本杂志的主编、副主编和编委,曾获得多种国际和地区性奖项40余项。
课题组网页:https://shrikezhang.com/
- 重庆大学司马文霞教授团队 ACS AMI:面向高湿、高盐地区电力装备的绝缘材料靶向自修复技术研究 2022-11-05
- 《Mater. Horiz.》:微流体技术高效可控制备类黑色素纳米材料 2020-04-27
- Matter:热整流梯度多孔高分子复合材料助力户外自降温热伪装 2026-02-07
- 郑州大学王建峰/王万杰 ACS Nano:具有珊瑚状多层次结构的双模式辐射制冷/加热多孔聚合物薄膜 2023-01-17
- 中山大学吴丁财教授课题组《Nat. Commun. 》:利用功能化多孔高分子隔膜显著改善锂金属电池的大电流循环稳定性和安全性 2019-04-02
