生物材料的快速发展,为更加安全、有效地治疗各类血管疾病,提供了新的工具。理想的血管支架材料,应支持血管内皮细胞在其表面粘附、铺展、并实现全面覆盖(“内皮化”),从而避免异物诱发血栓或血管堵塞。传统的材料,要么支持内皮细胞粘附效果不佳;要么是在对其表面修饰粘附“信号”(如可结合细胞整合素受体的肽段)后,提高了其促进内皮细胞生长的能力,但这些信号也同时支持其他类型的细胞粘附。那么,有什么办法可以选择性地促进内皮细胞在材料表面的铺展呢?
澳门大学王春明和南京大学董磊合作,设计了一种基于全新机制促进内皮化的多糖材料。他们注意到:当微生物(如真菌)感染机体时,须穿透内皮细胞从而侵袭组织(transmigration)。在这一过程中,微生物表面的多糖分子发挥了先锋作用,与内皮细胞表面或分泌的多种可识别糖的受体建立连接,从而“搭桥”突破内皮防线。这一特殊的机制为研究者带来灵感:将这些糖分子“进攻”内皮细胞时的独特作用,转变为引导内皮细胞特异性粘附的亲和能力,设计促进内皮化的糖生物材料基质(图1)。

图1. 受真菌侵染内皮细胞启发,设计材料表面内皮化的研究构思。
然而,第一,微生物表面与这些受体结合的糖链异质性高且难以大规模制备(就材料制备的量级来说);第二,多糖的水溶性使其不易加工成型。为解决这两个问题,研究者筛选植物来源的葡甘聚糖,并进一步进行不同碳链长度的酯化增加分子的疏水性,在经过分子模拟和点杂交实验验证后,获得了一种葡甘聚糖的癸酸酯(简称GMDE),对于内皮细胞分泌的Galectin蛋白具有选择性亲和能力。研究者进一步地将GMDE制备为薄膜材料和静电纺丝纤维,发现相比于同系列的其他糖酯衍生物,具有明显的促进内皮细胞粘附的优势。有趣的是,研究者同时对比成骨细胞、上皮细胞、成纤维细胞、及平滑肌细胞,它们在GMDE材料表面的粘附程度都远低于内皮细胞,证明了GMDE选择性支持内皮细胞粘附的能力。

图2. 不同类型的细胞,包括人(HUVEC)和鼠(SVEC4-10)内皮细胞及其他组织细胞,在GMDE和其他葡甘聚糖衍生物上的粘附情况
可是,GMDE是如何通过与Galectin的亲和来促进血管内皮细胞的粘附呢?为了回答这个问题,研究者设计了一系列生物学实验验证机理。首先,他们对比了人和鼠多种细胞分泌或表达几种主要糖受体或糖结合蛋白的丰度,发现内皮细胞表达和分泌Galectin的能力都高于另几种细胞。而且,相比于传统聚己内酯或玻璃材料,GMDE表面吸附Galectin的能力最强。进一步地,研究者观察到内皮细胞自身分泌的Galectin,以桥接的形式,一头搭在GMDE表面,一头衔接细胞表面的整合素b1受体(图3)。此外,内皮细胞的粘附,可被Galectin的竞争性抑制剂或整合素抗体破坏,从而证明了内皮细胞与多糖材料,通过Galectin “搭桥”联接这一独特美妙的方式。
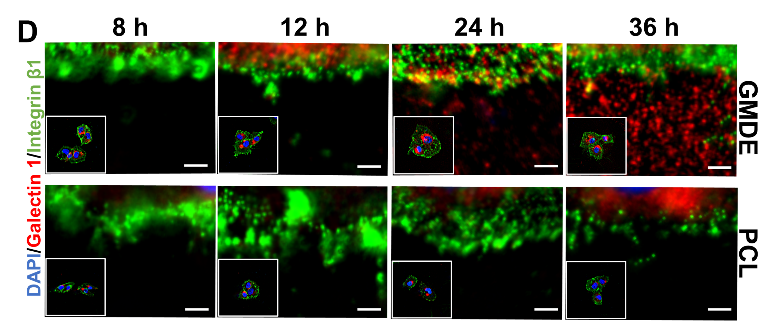
图3. 粘附在GMDE纤维支架上的HUVEC细胞分泌Galectin-1和表达integrin染色
最后,研究者评估了GMDE纤维支架在小鼠下肢缺血模型中对于血管治疗的潜力。他们通过将小鼠左下肢股深动脉结扎造成左下肢缺血,并保持右侧下肢肌肉健康。在动脉结扎处植入GMDE静电纺丝,聚己内酯静电纺丝作为对照,同时在结扎处注射PBS作为阴性对照,注射血管内皮生长因子VEGF作为阳性对照。对所有实验组进行为期28天的下肢血流灌注量的测定,研究者发现植入GMDE纤维支架后,缺血下肢血流灌注量高,缓解了因缺血导致的小腿肌肉坏死。而且通过CD31和α-SMA免疫荧光染色发现GMDE纤维支架可促进血管新生,且不会引起炎症反应。
该研究的材料设计思路新颖,既不修饰细胞粘附的肽段、也未添加外源性的促血管新生因子,而是基于糖分子与细胞受体的相互作用的生物化学机制,改善材料表面的内皮细胞选择性,可谓独辟蹊径,为相关生物材料的研发提供了与常规方法不同的思路。这一工作于2021年9月3日以A “Bridge-Building” Glycan Scaffold Mimicking Microbial Invasion for In Situ Endothelialization为题在线发表于Advanced Materials,澳门大学博士研究生母若雨和硕士研究生张钰函为共同第一作者,研究得到国家自然科学基金委员会优秀青年科学基金(港澳)、澳门科技发展基金的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202103490
- 浙江大学高长有团队 Prog. Mater. Sci.:用于组织修复的自适应性生物材料 2025-11-30
- 武汉理工戴红莲课题组 Coordin. Chem. Rev.:苯硼酸生物材料 - 从化学原理到材料设计 2025-09-23
- 北京大学邵元龙《Adv. Mater.》综述:用于组织电子设备接口的生物材料基纤维状植入式探针 2025-06-27
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 广西大学林宝凤教授团队 Carbohyd. Polym.: 基于天然多糖的绿色低温缓冲包装材料的研究 2025-07-23
- 兰州理工大学牛小慧/王坤杰团队 ACS Nano: 内含界面电场的手性多糖水凝胶材料 2025-07-14
- 大工王华楠教授团队 AFM:仿生设计4D打印多步响应Janus血管支架 2024-09-06
