脑胶质瘤是最具侵袭性和致死性的中枢神经系统原发性肿瘤,目前治疗脑胶质瘤的主要手段包括手术、辅助放疗和化疗。近年来,尽管脑胶质瘤的治疗已获得多方面的进展,但是由于血脑屏障(blood-brain barrier,BBB)的存在,导致进入颅内肿瘤部位的药物剂量仍然十分有限,因而脑胶质瘤的诊疗仍存在较大的局限性。因此,开发新型高效的药物递送体系,使治疗剂或造影剂跨越BBB输送至大脑内部进行脑肿瘤的精准诊断和高效治疗显得十分迫切和重要。细胞膜包覆法作为一种仿生策略在开发具有较高载药量、增强脑靶向性的智能药物递送系统方面具有极大的潜力。据文献报道,包覆了脑胶质瘤细胞膜的仿生纳米混悬剂可以进一步修饰靶向肽以用于穿越BBB并同源靶向脑胶质瘤,进行原位脑胶质瘤的有效治疗。然而在这种情况下,需要在癌细胞膜上额外插入靶向肽才能实现BBB穿越。值得注意的是,巨噬细胞表面高表达的整合素α4、β1等,可以与肿瘤部位的血管内皮粘附分子-1(VCAM-1)发生相互作用,促进巨噬细胞向肿瘤或转移瘤的迁移;而且巨噬细胞膜上的整合素α4、β1或巨噬细胞-1抗原(Mac-1)等在穿越BBB特异性靶向脑胶质瘤中也起到至关重要的作用。因此,利用巨噬细胞膜仿生策略,有望协助纳米药物有效地跨越BBB,进行原位脑胶质瘤的诊疗。
近日,东华大学史向阳教授课题组和上海市第一人民医院王悍教授合作,以还原响应的聚N-乙烯基己内酰胺纳米凝胶(PVCL NGs)作为载体,通过在其内部负载MnO2和化疗药物顺铂,得到粒径为106.3 nm的胶体稳定性良好的NGs; 再在其外部包覆巨噬细胞膜,得到了巨噬细胞膜仿生多功能响应型载药纳米凝胶(MPM@P NGs,图1A),实现了MR成像实时监测的原位脑胶质瘤的联合治疗(图1B)。
制备的MPM@P NGs体系具有如下优势:
-
(1)纳米凝胶固有的流动性和变形性使其易于被细胞膜包覆;
-
(2)利用巨噬细胞膜上的特异性蛋白(如整合素α4、β1等)与肿瘤部位的VCAM-1之间的作用,赋予其跨越BBB靶向脑胶质瘤的功能;
-
(3)含二硫键(S-S键)的N,N''''-双(丙烯酰)胱胺(BAC)交联的PVCL纳米凝胶对肿瘤细胞中较高浓度的GSH(10 mM)具有还原响应性,GSH可以使S-S键断裂,纳米凝胶瓦解,从而控制药物在肿瘤位置的释放;
-
(4)MnO2也可以与GSH反应生成具有更高弛豫率的Mn2+(r1= 9.69 mM-1s-1),Mn2+不仅具有优异的MR成像效果,还可以与肿瘤微环境中的双氧水(H2O2)发生类芬顿(Fenton-like)反应,生成高毒性的羟基自由基(·OH);
-
(5)S-S键交联的PVCL NGs和MnO2通过下调GSH水平减少对·OH的消耗,有助于增强化学动力学治疗(CDT)效果。

图1. 巨噬细胞膜包覆的MM-Pt/MnO2@PVCL NGs(MPM@P NGs)的制备路线示意图(A),MPM@P NGs跨越血脑屏障进行原位脑胶质瘤的MR成像和联合化疗/化学动力学治疗应用(B)。
通常,肿瘤细胞内高水平的GSH会将类芬顿试剂产生的·OH清除,降低其对肿瘤的杀伤效果。在该体系中,S-S键交联的PVCL NGs和MnO2通过消耗GSH有效减少肿瘤微环境中过量GSH对·OH的清除作用,从而进一步增强化学动力学治疗效果。使用2′, 7′-二氯荧光素二乙酸酯(DCFH-DA)作为荧光探针,通过激光共聚焦扫描显微镜(CLSM)检测经不同材料处理后肿瘤细胞内ROS的产生情况。如图2 A-B所示,PBS处理的C6细胞中绿色荧光非常微弱,而Mn2+处理的C6细胞中显示出比PBS对照组较强的DCF荧光,证实Mn2+通过类芬顿反应可以将细胞内的H2O2转化为高活性的·OH。此外在M@P NGs处理的C6细胞中观察到了明显增强的DCF荧光,且显著高于Mn2+处理组(p < 0.01),这可能是由于PVCL和MnO2诱导的GSH清除效应减少了过量GSH对·OH的消耗所致。他们通过测试细胞内的GSH水平验证了这一结果,如图2 C所示,M@P NGs 处理的脑胶质瘤细胞中GSH含量(63.6%)显著低于Mn2+组(80.5%)。

图2. 经不同材料处理6 h后,通过CLSM观察到的C6细胞内ROS的产生情况(A)及各组细胞中的DCF荧光强度(B);利用GSH/GSSG检测试剂盒测得的C6细胞内的相对GSH含量(C)。
特别地,用负载了cisplatin的PM@P NGs处理的C6细胞中,绿色DCF荧光进一步增强(p < 0.05)。一种可能的机制是cisplatin可以激活NOX(一种烟酰胺腺嘌呤二核苷酸磷酸氧化酶家族)使其将电子传输到O2分子并生成O2·-,随后O2·-可被超氧化物歧化酶(SOD)(Ma et al., Nano Lett., 2017, 17, 928-937)歧化产生H2O2,H2O2进而与Mn2+作用生成了更多的下游·OH。此外他们看到,经MPM@P NGs处理的C6细胞表现出了最高的绿色荧光强度(p < 0.01),这可能是由于巨噬细胞膜的包覆改善了NGs的内吞作用。
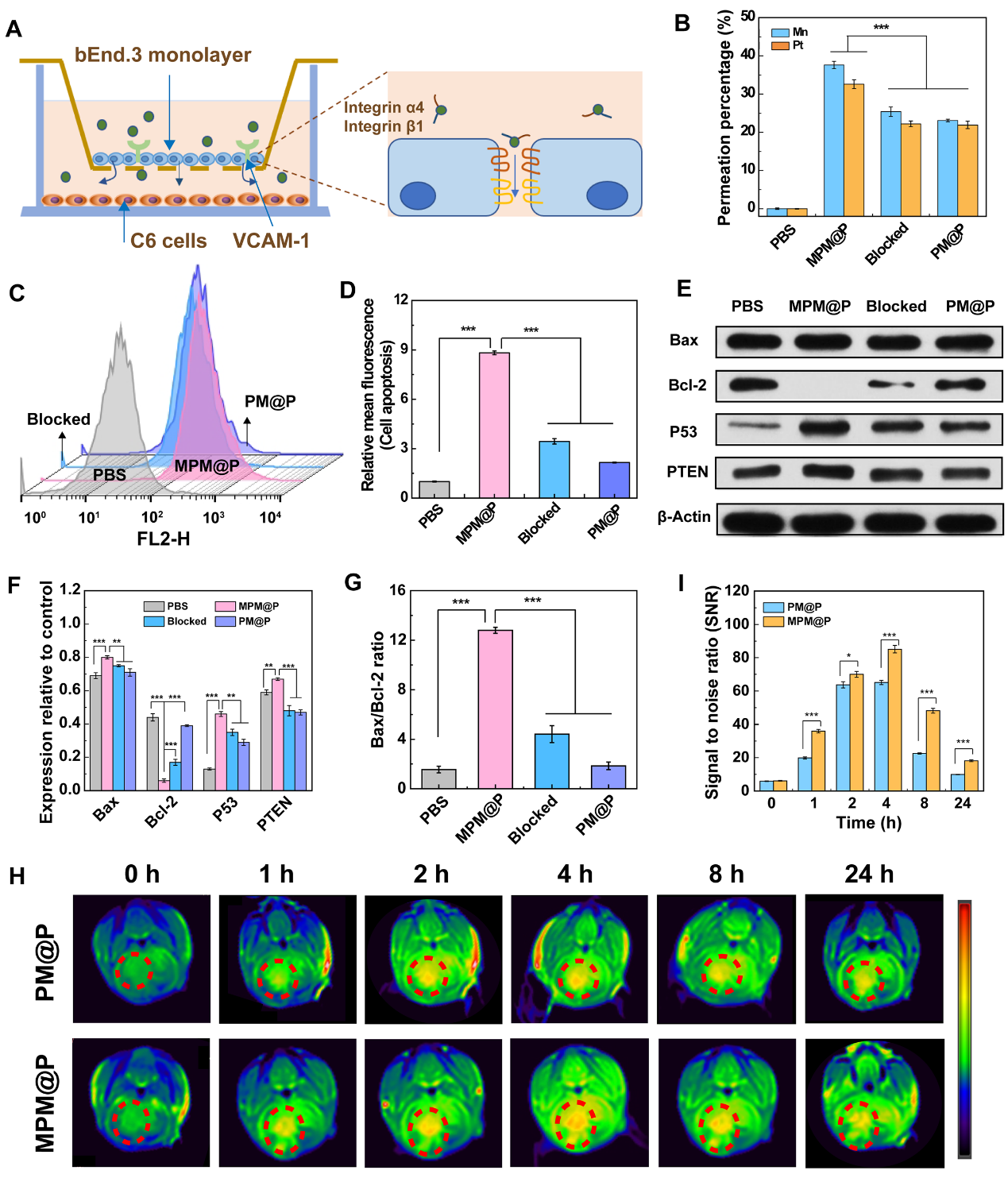
图3. 体外BBB模型示意图(A);不同材料穿越BBB到达下室的Mn/Pt渗透百分数(B),C6细胞与渗透到下室的材料孵育24 h,通过流式细胞术检测的细胞凋亡情况(C)以及各组凋亡细胞对应的平均荧光强度(D),通过Western blot分析的凋亡相关蛋白的表达情况(E-G)。
研究表明,巨噬细胞膜的包覆降低了纳米药物的非特异性蛋白吸附,延长了血液半衰期(t1/2 = 3.37 h),并表现出良好的生物相容性。体外Transwell迁移实验(图3 A-G)和体内原位脑胶质瘤模型的MR成像(图3 H-I)结果均显示,巨噬细胞膜上的整合素α4和β1有效促进了NGs 跨越BBB并靶向脑胶质瘤。MPM@P NGs跨越BBB到达下室的比例最高(Mn: 37.6 ± 0.93%,Pt: 32.6% ± 1.12%),并通过激活凋亡相关通路诱导更多的肿瘤细胞发生凋亡。进一步的体内治疗结果证明,由于增强的CDT/化疗联合治疗和巨噬细胞膜辅助的BBB穿透/靶向作用等因素的影响,MPM@P NGs治疗组呈现出最小的肿瘤体积和延长的存活期。
以上研究以“Macrophage Membrane-Camouflaged Responsive Polymer Nanogels Enable Magnetic Resonance Imaging-Guided Chemotherapy/Chemodynamic Therapy of Orthotopic Glioma”为题,发表在SCI期刊ACS Nano(DOI: 10.1021/acsnano.1c08689)上。东华大学化学化工与生物工程学院博士研究生肖婷婷为第一作者,史向阳教授和上海市第一人民医院的王悍教授为共同通讯作者。该工作得到了中德科学研究中心、国家自然科学基金、上海市科委优秀学术带头人及中央高校研究生创新基金等项目的资助。
文章链接:https://pubs.acs.org/doi/full/10.1021/acsnano.1c08689
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
- 山东大学栾玉霞教授团队 Nat. Nanotech.:发现解决CAR-T细胞疗法实体瘤疗效受限的有效方法 2025-05-20
- 东华大学史向阳教授 Nano Today:仿生金属-多酚网络包覆弹性蛋白样多肽胶束实现原位脑胶质瘤的声动力/化学动力/免疫治疗 2025-05-28
- 烟台大学陈大全教授团队:结合中医药引经理论,构建基于桔梗多糖的巨噬细胞膜仿生纳米载体用于靶向肺炎以及平息细胞因子风暴 2022-02-11
- 四川大学高会乐教授课题组Biomaterials:巨噬细胞膜包被的激光响应性纳米递药系统用于肿瘤的免疫治疗 2020-06-23
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
