生命活动相关的信号通路常常通过蛋白质复合体构象的形成而激活,例如炎症小体的组装,受体蛋白的寡聚化。而这些蛋白质复合物的产生很大程度上依赖于其他分子的识别。迄今为止,体内精准调控蛋白功能仍收到很大挑战,活体自组装作为一类新发展的纳米技术在蛋白调控领域具有广泛的应用价值。目前用于活体多肽自组装分子设计的组装片段多为强疏水片段,这类组装片段在种瘤原位药物富集以及长滞留方面有很好的应用,但对于精准蛋白调控方面仍有欠缺。故发展新型多肽组装片段用于活体多肽自组装材料的设计是尤为重要的。
近日,国家纳米科学中心王浩研究员课题组在《Angew. Chem. Int. Ed.》期刊上发表了题为“In Situ Self-Assembly of Bispecific Peptide for Cancer Immunotherapy”的工作(DOI:10.1002/anie.202113649)。该工作发展了一种新的原位触发多肽自组装的策略——靶向-招募-自组装(TRA)策略。作者首先将多肽序列GNNQQNY(组装片段)-RGD(靶向片段)(G7-RGD)作为模板肽进行组装机制研究。该多肽序列在低浓度溶液态中以单分子状态存在。当其靶向到受体蛋白上时,多肽分子的运动得到限制,从而降低了其自组装所需的活化熵进而触发其在原位的自组装成为纳米纤维。这种蛋白原位多肽组装体称之为多肽折叠体(peptide foldamer)。利用ThT荧光检测发现,蛋白与多肽的配受体相互作用可使多肽的临界组装浓度从525 μM降低至33μM。
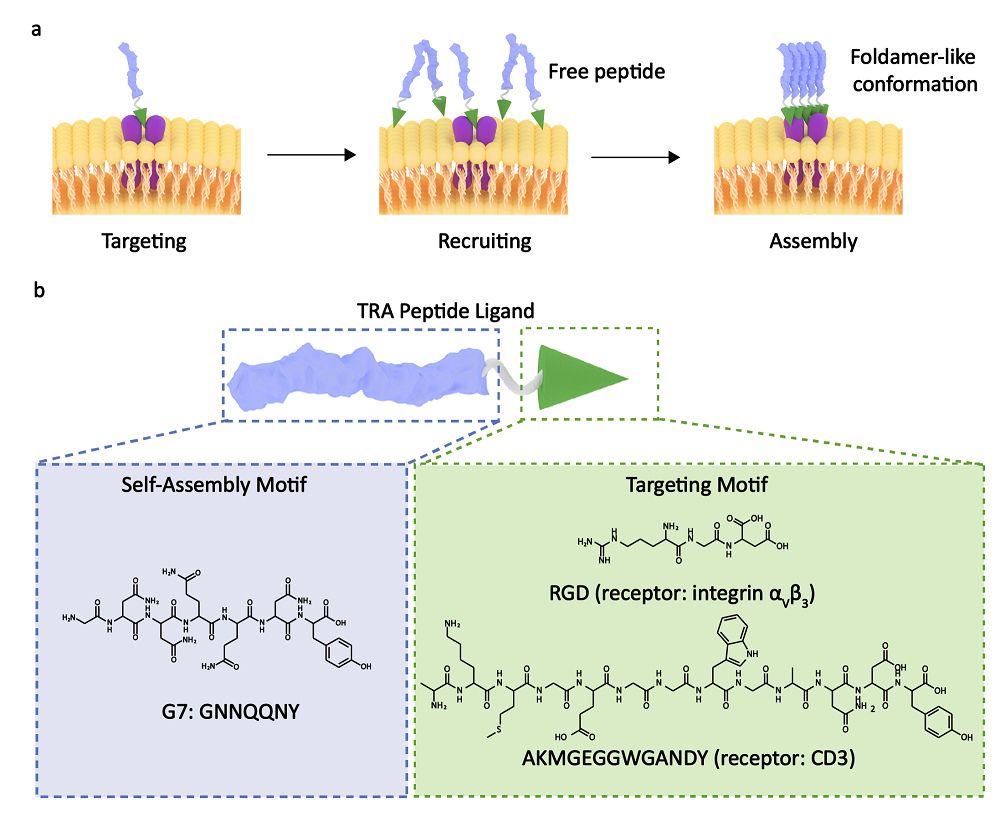
图1 a) 靶向-招募-自组装(TRA)策略示意图 b) TRA多肽序列设计
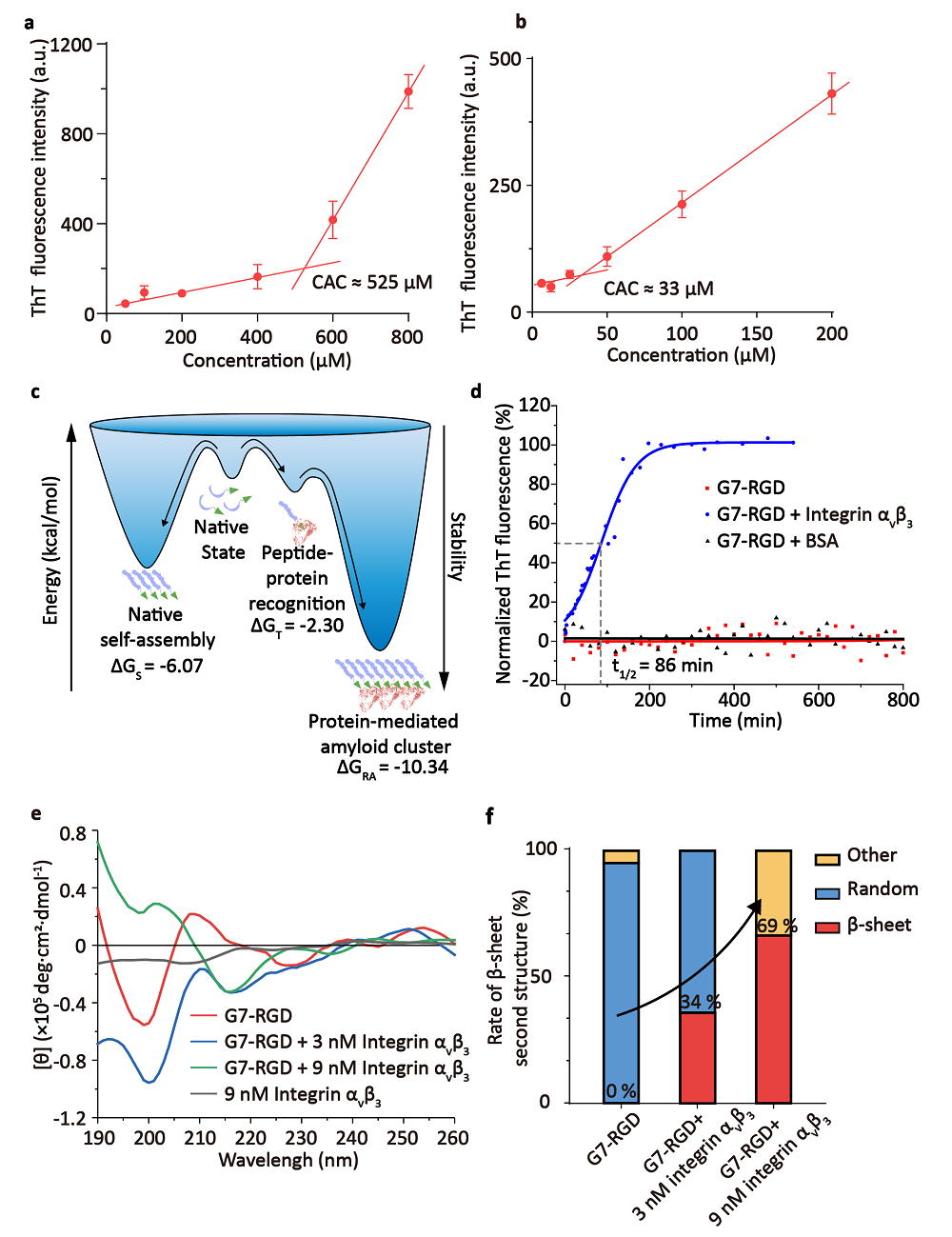
图2 a) ThT荧光测定G7-RGD分子临界组装浓度 b)ThT荧光测定整合素蛋白诱导下的G7-RGD分子临界组装浓度 c)G7-RGD在不同相互作用下的吉布斯自由能 d) G7-RGD和整合素诱导的G7-RGD自组装ThT动力学曲线 e) 不同浓度的整合素诱导G7-RGD自组装的圆二色曲线 f) 整合素诱导的G7-RGD自组装不同二级结构含量的定量研究

图3 a-b) G7-RGD(含有2% NBD标记的G7-RGD)与大囊泡共孵育的共聚焦图像以及其荧光定量动力学曲线 c-d) G7-RGD(含有2% NBD标记的G7-RGD)与MCF-7细胞共孵育的共聚焦图像以及其荧光定量动力学曲线 e)细胞膜上多肽自组装纳米纤维的伪彩色SEM图像(绿色为多肽自组装体)f)NBD-G7-RGD分子处理MCF-7细胞后的共聚焦图像的XYZ和3D视图。
此外,在多肽自组装的同时,会招募游离多肽分子和其它受体蛋白结合的多肽分子从而诱导受体蛋白的寡聚化。利用这一现象,他们将RGD靶向片段替换成可以靶向CD3受体蛋白的靶向肽antiCD3:AKMGEGGWGANDY,构建成新的分子antiCD3-G7。该分子靶向T细胞表面的CD3受体,进而通过原位自组装诱导CD3受体的寡聚化,在CD28和IL-2辅助下,在体外激活T细胞。最后他们受启发于双抗分子的设计,构建了双靶向分子antiCD3-G7-RGD,该分子在体外首先激活T细胞,此外,RGD靶头赋予了T细胞识别癌细胞的能力从而使T细胞杀伤癌细胞。相比于传统的CD3抗体,双靶向分子赋予T细胞识别癌细胞的特异性。这种类双抗的设计赋予多肽新的应用前景。

图4 a) 多肽自组装体招募游离多肽示意图 b) NBD-G7-RGD(绿色信号)和Cy-G7(红色信号)在MCF-7细胞上共定位 c) (b)白线区域的归一化荧光强度曲线
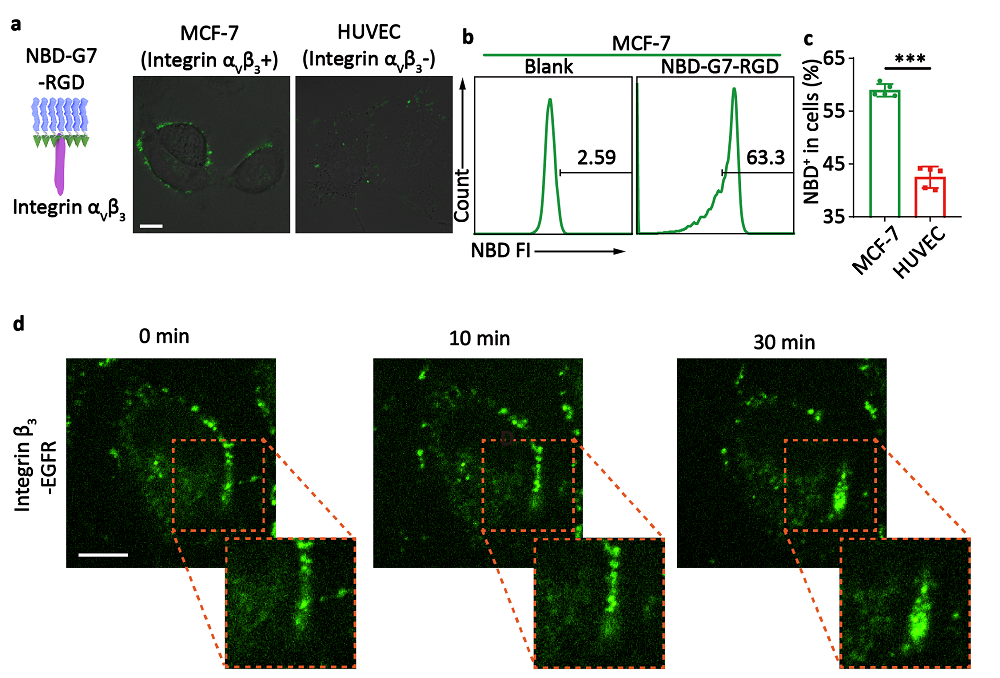
图5 流式细胞术和共聚焦显微镜验证G7-RGD诱导整合素受体寡聚化

图6 流式细胞术和共聚焦显微镜验证G7-antiCD3诱导CD3受体寡聚化

图7 AntiCD3-G7-RGD靶向T细胞CD3受体,原位形成纳米纤维并激活T细胞
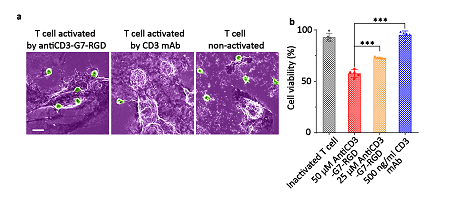
图8 AntiCD3-G7-RGD激活的T细胞用于癌细胞杀伤
王浩课题组长期从事活体多肽自组装的研究工作。组内利用酶响应实现生物活性分子在肿瘤局部自组装取得了一系列进展(Adv. Mater.2015, 27, 6125-6130,Nat. Commun. 2019, 10, 4861)。在前期工作的基础上,团队此次开发了新的组装肽用于活体原位自组装,省略了酶剪切单元,利用配体受体相互作用,对多肽的自由活动进行限制,降低其成核组装所需要的活化熵,触发其原位自组装。近期,利用这一概念,组内发展了新型PDC药物,在靶向受体同时原位组装成为纳米寡聚体,促进细胞对PDC药物的内吞(Biomaterials, 2021, 278, 121139)。在本篇工作中,他们增强了组装序列的组装能力,使其在细胞膜上短时间内快速组装成较大的纳米纤维,诱导膜受体寡聚化,激活下游通路。该工作的第一作者为博士研究生王曼迪,博士研究生吕甘田为本文的共同第一作者。王浩研究员为本文的通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202113649
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 东华大学史向阳教授 Nano Today:仿生金属-多酚网络包覆弹性蛋白样多肽胶束实现原位脑胶质瘤的声动力/化学动力/免疫治疗 2025-05-28
- 华东理工刘润辉教授课题组 AFM:功能化聚-β-多肽组装体抗耐药真菌感染 2025-05-09
- 苏大陈倩教授团队《Mater. Today》:超声触发原位自组装药物水凝胶 - 为肝动脉灌注化疗带来新范式 2025-12-20
- 北航陈爱华教授课题组《Macromolecules》:分离原位交联用于提高聚合诱导自组装制备的反相双连续结构的稳定性 2025-10-08
- 华东理工大学蔡春华教授 Angew:聚肽自组装形成三角形纳米环 2025-09-24
- 哈工大马军/邵路/程喜全团队 Nat. Commun.:顺序结晶法制备超耐久纳米纤维膜 2025-12-23
