在腹腔/盆腔肿瘤的放射治疗中,正常肠道组织会不可避免地受到辐照的损伤,进而导致消化系统功能障碍甚至死亡。由于放疗辐照范围因人而异,小肠的受损部位也难以预测,因此对小肠全长的全面辐射防护是一个亟待解决的问题。氨磷汀(Amifostine,AMF)是唯一被美国食品药品管理局(FDA)批准用于临床的辐射防护药物,可选择性保护正常组织免受辐射损伤,但其由于易于代谢、酸性失活等缺陷,仅被用于静脉给药,难以应用于肠道辐射防护,因此,开发克服该药物口服障碍的给药策略,将有希望实现对肠道的有效辐射防护。
近日,浙江大学周民教授团队联合哈佛大学医学院陶伟教授团队,在上述问题的研究中取得新进展,在Nature Communications发表题为Microalgae-based oral microcarriers for gut microbiota homeostasis and intestinal protection in cancer radiotherapy的研究论文。该研究利用一种可食用的天然微藻,螺旋藻,通过简易的脱水-复水化策略,装载辐射防护药物氨磷汀,制备用于口服的药物递送系统(SP@AMF),以保护药物不被胃酸灭活,并通过肠道长时间滞留和药物缓释,实现在小肠各段均匀的高浓度药物分布,从而有效保护小肠全长免受辐照损伤。
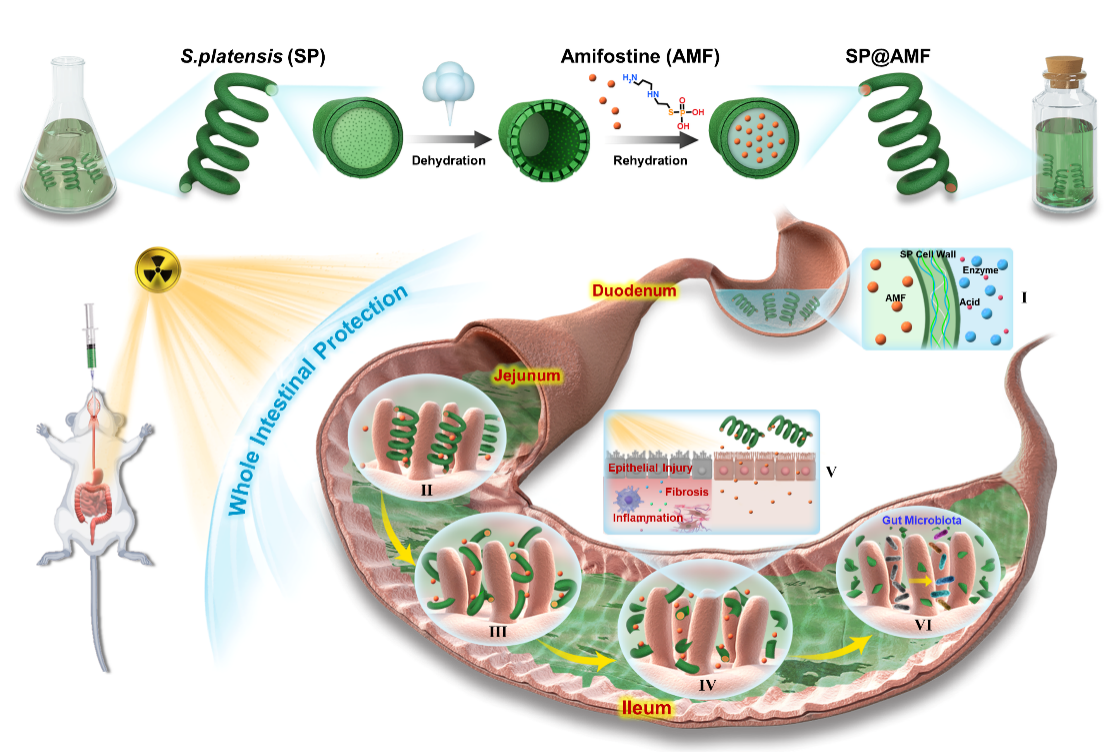
图1基于天然微藻的口服药物递送系统的合成步骤及其肠道辐射防护作用原理
该口服药物递送系统可在胃酸中有效保护药物活性,其200-500微米级别尺寸以及螺旋形态有助于其在肠绒毛间的滞留和药物缓释;该系统可随胃肠道消化作逐渐破碎,有助于药物在肠道的充分释放及分布。
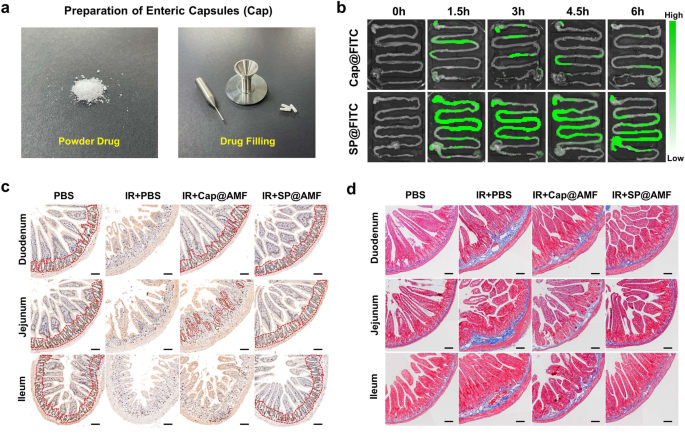
图2 螺旋藻放疗药物递送系统可以实现更全面的肠道长滞留和高摄取,全方位保护肠道放疗损伤
相比游离药物及其肠溶胶囊,该口服递送系统表现出更全面、更优越的肠道防护效果。在原位结肠癌放疗模型中,该系统表现出对正常肠道的选择性保护,不影响肿瘤的辐照杀伤。此外,基于螺旋藻本身的菌群调节作用,该系统有利于维持辐照后的肠道菌群平衡,有助于营养吸收及辐照损伤的恢复。
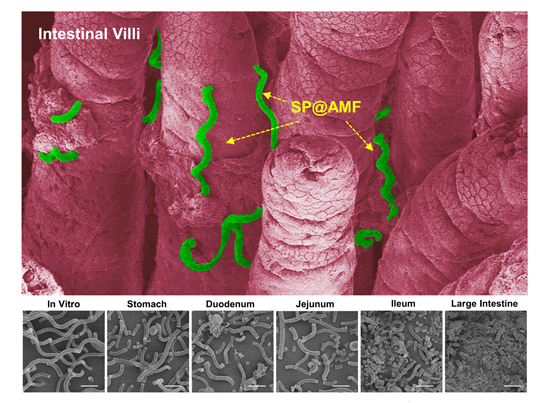
图3 在递送系统在肠绒毛间的滞留及在消化道各部位的逐级降解
肠道辐射损伤是临床常见的放疗不良反应,严重损害肿瘤放疗效果和患者的生存质量,针对这一问题,具有临床转化潜能的新型材料或药物递送系统仍较为缺乏。本研究基于可再生天然微藻的口服给药系统,不仅易于低成本制备和量产,而且效果优于常见商业化口服材料,展现出较大的临床转化及应用潜力。
浙江大学转化医学研究院周民团队博士生张东晓、浙江大学转化医学研究院周民团队博士生钟丹妮和哈佛大学医学院Jiang Ouyang是论文的共同第一作者,浙江大学周民研究员,哈佛大学医学院陶伟教授和哈佛大学工程与应用科学学院Xingcai Zhang为论文的共同通讯作者。研究工作得到了国家自然科学基金、浙江省重点研发计划专项等项目资助。
原文链接:https://www.nature.com/articles/s41467-022-28744-4
- 浙江大学周民团队《ACS Nano》:微藻-胰岛素复合口服递送系统 2023-07-07
- 浙江大学周民团队 ACS Nano:口服微藻-纳米复合递送系统预防放射性损伤 2023-06-01
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 华东理工刘润辉教授、叶邦策教授 AHM:新型口服递送系统包封智能工程菌用于炎症性肠病治疗 2024-12-20
- 清华大学张明君教授和徐静副教授团队 Sci. Adv.:肠驱动仿生微针机器人用于生物类药物无痛口服递送 2024-01-11
