东华大学陈志钢教授团队《ACS AMI》:酶响应聚合物纳米颗粒用于内-外源动态刺激下的肿瘤治疗
2022-06-30 来源:高分子科技
聚合物纳米材料具有高生物相容性、可控药物释放、选择性肿瘤积聚等优点,在癌症治疗中独具优势。其中一部分聚合物纳米材料可响应内刺激源(谷胱甘肽、活性氧、过表达酶),另一部分则响应外刺激源(光、声、磁等)。可同时响应多内刺激源和多外刺激源的聚合物纳米材料具有协同效应,研究多内-外源刺激与聚合物纳米材料之间的相互作用对肿瘤安全高效诊疗十分重要。
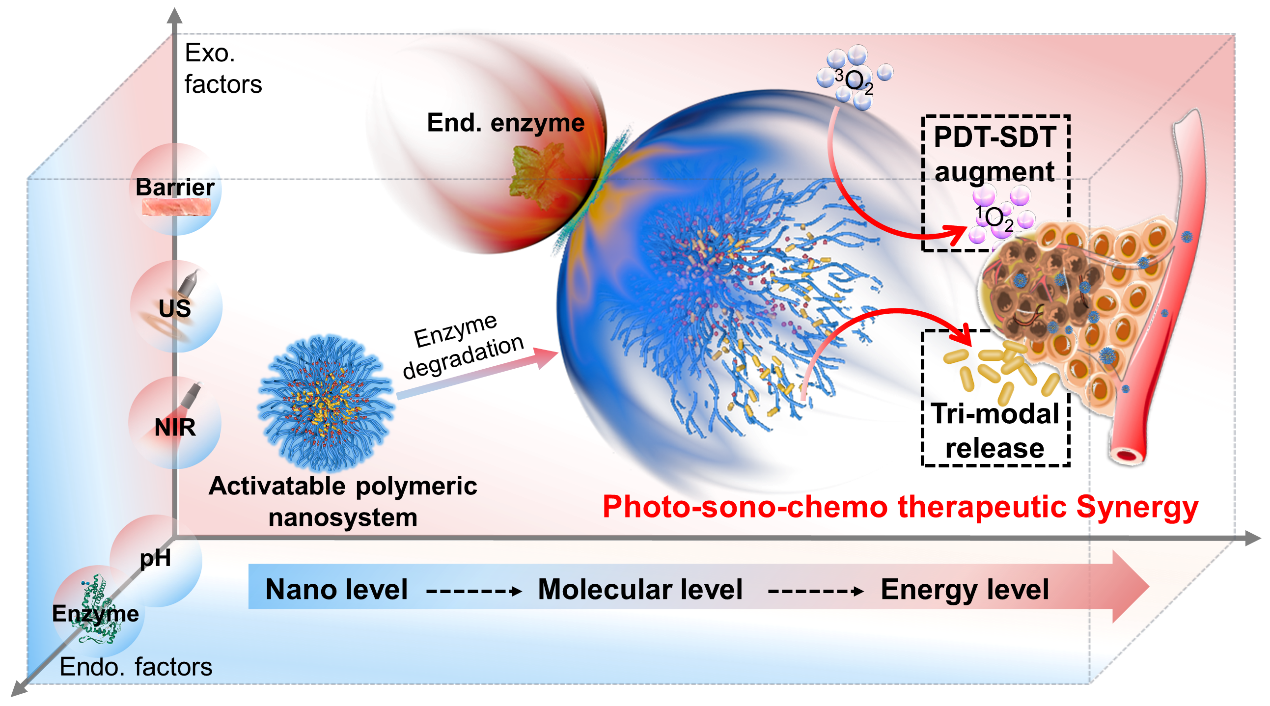
图1 多内-外源刺激响应聚合物纳米颗粒的肿瘤治疗示意图
近期,东华大学材料科学与工程学院陈志钢教授团队合成了具有多内-外源刺激的聚合物纳米材料(DOX@HPNAs), 探究了多内-外源刺激与聚合物纳米材料之间的相互作用,从而引导肿瘤多模式治疗(图1)。
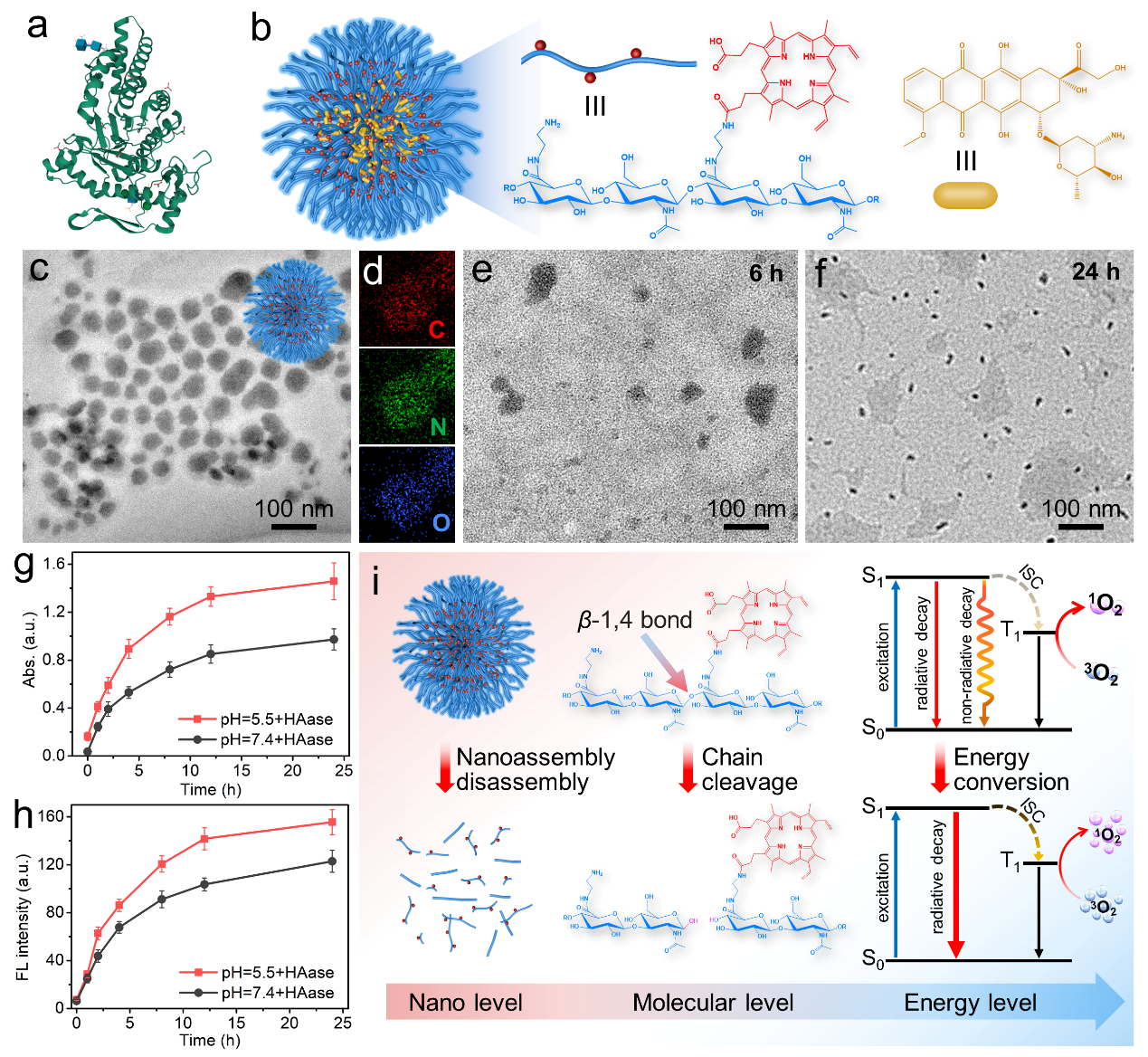
图2 酶降解过程中聚合物纳米颗粒在纳米-分子-能量层级的动态效果
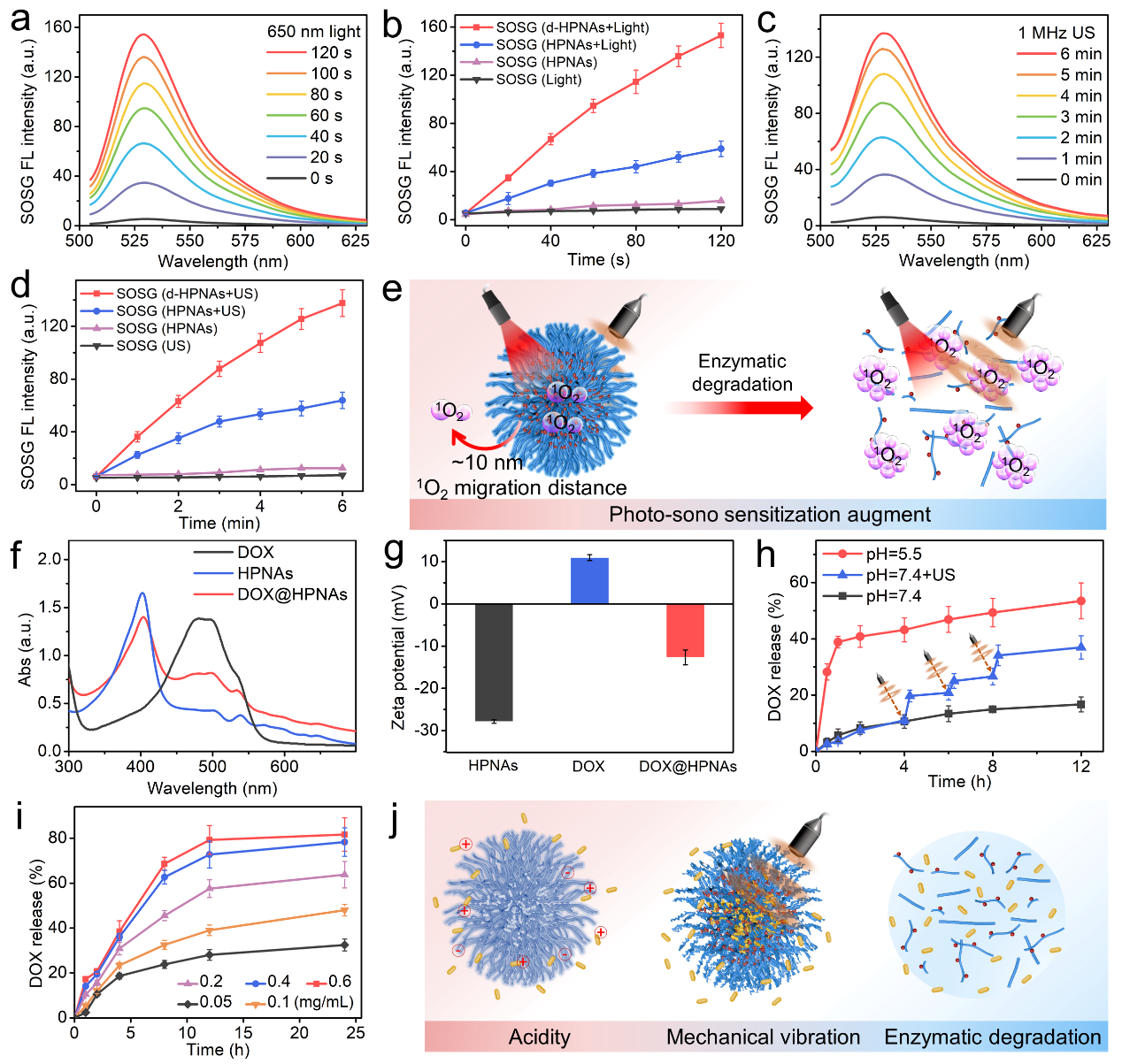
图3 聚合物纳米颗粒的酶降解增强光-声效应、三模式药物释放性能
论文信息:
Pu Qiu, Mengmeng Huang, Shiwen Wu, Mei Wen, Nuo Yu*, and Zhigang Chen* Dynamic Effects of Endo-Exogenous Stimulations on Enzyme-Activatable Polymeric Nanosystems with Photo-Sono-Chemo Synergy. ACS Appl. Mater. Interfaces 2022, DOI: 10.1021/acsami.2c05276.
原文链接: https://doi.org/10.1021/acsami.2c05276
课题组网站:https://pilab.dhu.edu.cn/zgchen/main.psp
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 南京大学甄叙、蒋锡群团队《Nano Lett.》: 余辉/光热双功能共轭聚合物纳米材料用于保乳手术术后精确辅助治疗和早期复发诊疗 2023-05-10
- 南京大学甄叙、蒋锡群团队《Adv. Mater.》: 光控自富集的仿生半导体聚合物纳米材料用于精准肿瘤血管损伤治疗 2023-03-23
- 南京大学甄叙、蒋锡群团队 Adv. Sci.:基于共轭聚合物纳米材料的大肿瘤声动力治疗 2022-01-07
- 浙江大学张鹏/王幽香 Adv. Sci.:具有交替序列的聚(谷氨酸-赖氨酸)EK肽水凝胶 - 可抵抗小鼠和灵长类动物的异物反应 2024-02-27
- 天津大学刘文广教授、天津医院杨强主任医师 AFM:核酸碱基驱动的透明质酸可注射黏附水凝胶增强退变性椎间盘修复 2024-03-13
- 四川大学孙勇/白浪《Small》:固定四环素的透明质酸纤维调节黏附性胶原基凝胶稳定性加速感染伤口愈合 2023-07-19
- 北京基础医学研究所刘志强/袁增强、浙江大学相佳佳 AFM:蛛网启发的具有微环境靶向性及多级响应功能的粘性纳米系统 2023-06-16
