南开大学刘阳研究员团队《Adv. Funct. Mater.》:聚合物强化脂质体用于肿瘤光动力免疫治疗
2022-10-20 来源:高分子科技
近年来,利用机体自身免疫系统消除肿瘤的癌症免疫疗法受到广泛关注,并逐渐发展成为一类极具潜力的癌症治疗手段。光动力疗法通过诱导免疫原性细胞死亡(immunogenic cell death,ICD)展现出将肿瘤细胞原位转化为疫苗的潜力,有望有效激活并维持抗肿瘤免疫效应。然而,单一光动力疗法所引发的抗肿瘤免疫效应并不足以有效抑制肿瘤增殖及转移。导致这一结果的主要原因是瘤内树突状细胞(dendritic cells,DCs)对肿瘤相关抗原(tumor-associated antigens,TAAs)的交叉呈递效率有限。因此,研发高效提升瘤内TAAs交叉呈递的策略,对提高ICD诱导的适应性抗肿瘤免疫效果具有重要意义,也具有重大临床转化价值。

图1. IERL-P通过促进TAAs在DCs中的交叉呈递进而增强ICD诱导的适应性抗肿瘤免疫效应
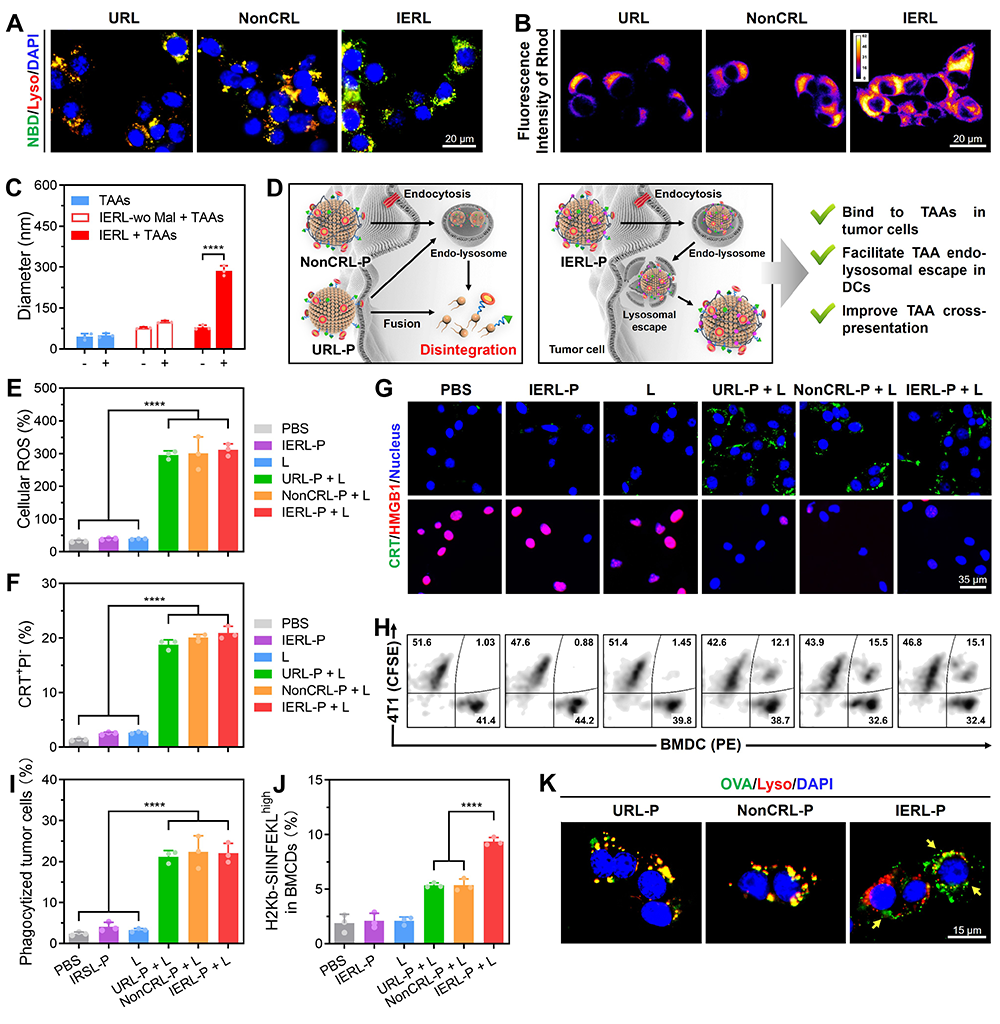
图2. IERL-P通过促进TAAs在DCs中的溶酶体逃逸显著提升TAAs交叉呈递效率

图3. IERL-P抑制原位肿瘤生长并降低肿瘤肺部转移风险

图4. 联合免疫检查点疗法抑制远端肿瘤生长
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202209711
作者团队简介:
刘阳研究员课题组,主要从事面向重大疾病治疗的医用高分子纳米材料的研究,包括功能高分子材料及纳米药物递送载体的设计构建、纳米载体体内分布和其药代动力学的研究,纳米-生物界面相互作用及生物过程调控等方面的研究。相关科研成果发表在Nat. Nanotechnol.、Adv. Mater.、Adv. Funct. Mater.、Angew. Chem. Int. Ed.、CCS Chem. 等学术权威期刊。版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 浙理工邵建中教授团队 CEJ:以变色龙为灵感的高颜色饱和度和高色牢度的非密堆积光子晶体结构生色纺织品 2024-03-01
- 天津大学刘文广/崔春燕团队、天津医院杨强团队 AFM:珊瑚启发的原位成孔的生物活性黏合剂用于兔桡骨骨折修复 2025-06-04
- 华科大杨光教授团队《Bioact. Mater.》综述:含有生物活性分子和干细胞的载体型水凝胶用于缺血性脑卒中治疗 2025-03-09
- 上海交大赵慧教授、朱申敏教授团队《ACS Nano》:仿生手性螺旋结构触发的“生物活性”治疗性接触镜用于角膜损伤快速修复 2025-03-01
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
