光激活荧光分子在光照下通过光化学反应从最初的暗态转变为高亮度的荧光态,以及高精准的时空可控性,在生物医学领域受到广泛的关注。文献中报道的基于不同光化学反应机制的光激活荧光探针,有自身或者共同的局限性,如高能量的紫外光作为激发源、光激活效率低、聚集态下荧光自猝灭、缺乏体内的光激活成像以及产生有毒的副产物等,限制了其在生物医学中的广泛应用。因此,开发具有光激活效率高、激发和发射波长可调、光动力活性优异的新型光激活分子应用于生物医学研究是非常有必要的。
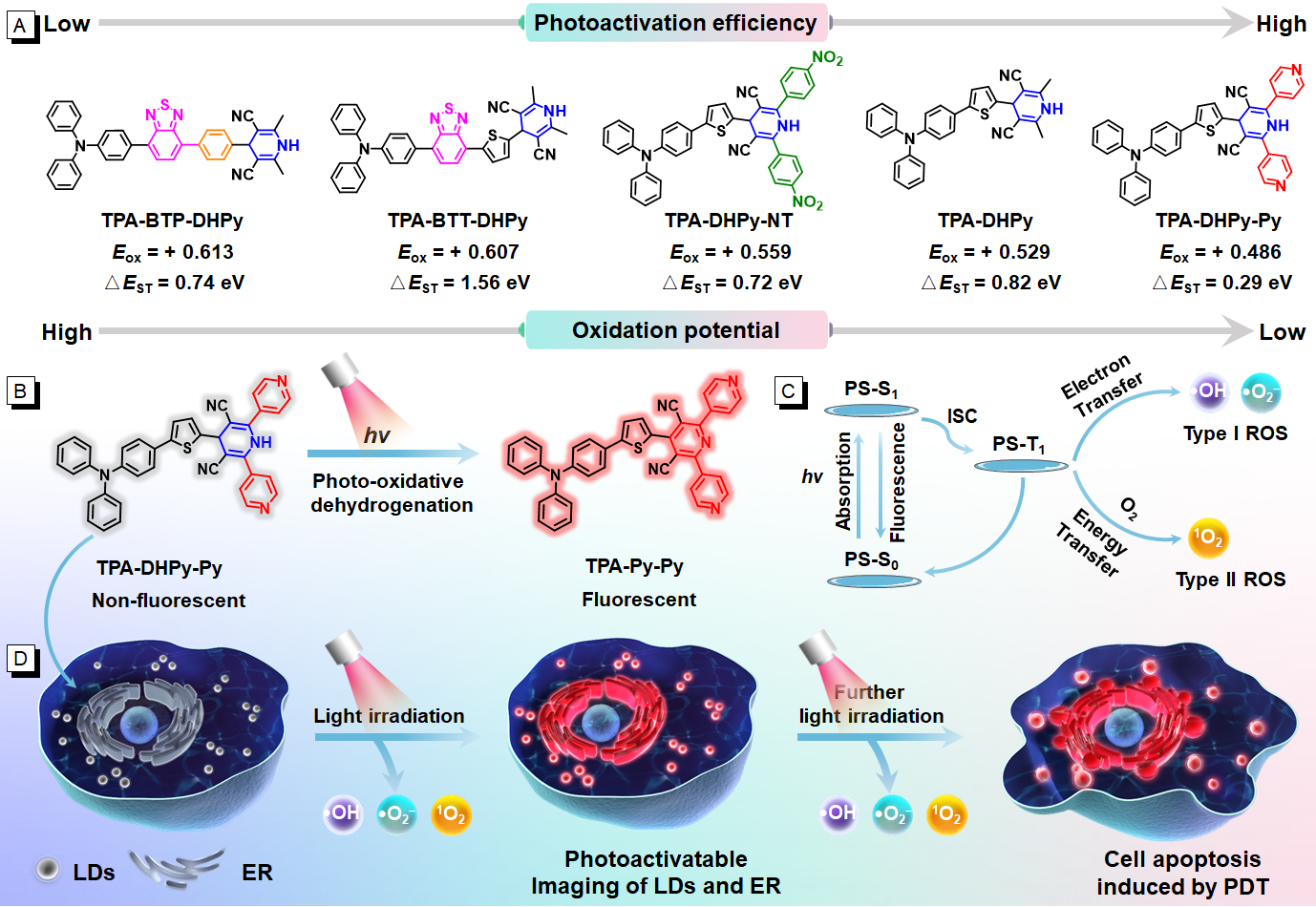
图1(A)1,4-二氢吡啶衍生物的分子工程化;(B)TPA-DHPy-Py的光氧化脱氢转变;(C)光敏剂的光物理与光化学机制;(D)脂滴和内质网的光激活成像与光动力治疗
近期,唐本忠院士/王东教授团队通过分子工程化的策略,优选出基于1,4-二氢吡啶的光激活分子TPA-DHPy-Py,具有高的光激活效率和兼具I型和II型的光动力活性(图1)。通过光氧化脱氢反应产生的吡啶类分子TPA-Py-Py具有聚集诱导近红外发射和优异的活性氧产生效率。在光照下,TPA-DHPy-Py能够实现脂滴和内质网的光激活成像,以及原位监测氧化应激下脂滴的融合和内质网的空泡化,并实现体内肿瘤的光激活成像。由于光照下优异的光动力活性,TPA-DHPy-Py能有效地杀灭体外癌细胞和抑制体内肿瘤的生长。因此,具有高光激活效率和光动力活性的光激活分子TPA-DHPy-Py用于癌症的精准诊疗是非常有前景的。
在本研究中,作者首先通过紫外吸收光谱的变化、氧化电势和荧光光谱等表征手段,证实TPA-DHPy-Py具有高的光激活效率、最低的氧化电势和优异的光动力活性(图2)。
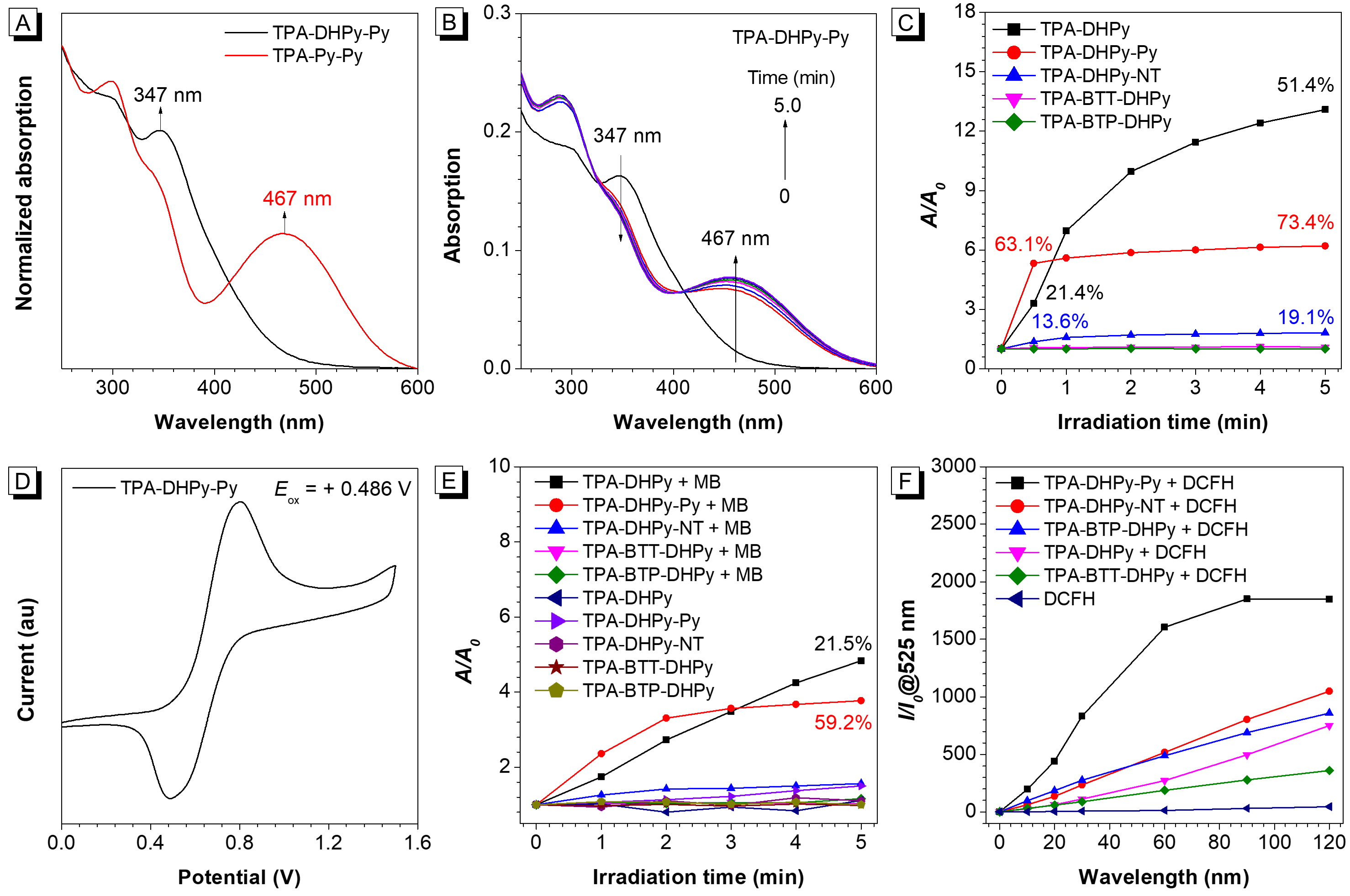
图2(A)TPA-DHPy-Py和TPA-Py-Py在DMSO/水(fw = 99%)混合体系中的紫外可见光吸收光谱;(B)TPA-DHPy-Py在光照下的紫外吸收随时间的变化图;(C)TPA-DHPy,TPA-DHPy-Py,TPA-DHPy-NT,TPA-BTT-DHPy和TPA-BTP-DHPy随光照时间的相对吸收强度的变化图;(D)TPA-DHPy-Py的氧化电势图;(E)TPA-DHPy-Py,TPA-DHPy,TPA-DHPy-NT,TPA-BTT-DHPy和TPA-BTP-DHPy在存在/不存在亚甲基蓝(MB)的情况下随660 nm激光光照时间延长的相对吸收强度的变化图;(F)在TPA-DHPy-Py,TPA-DHPy,TPA-DHPy-NT,TPA-BTT-DHPy和TPA-BTP-DHPy存在下的DCFH的相对荧光强度变化
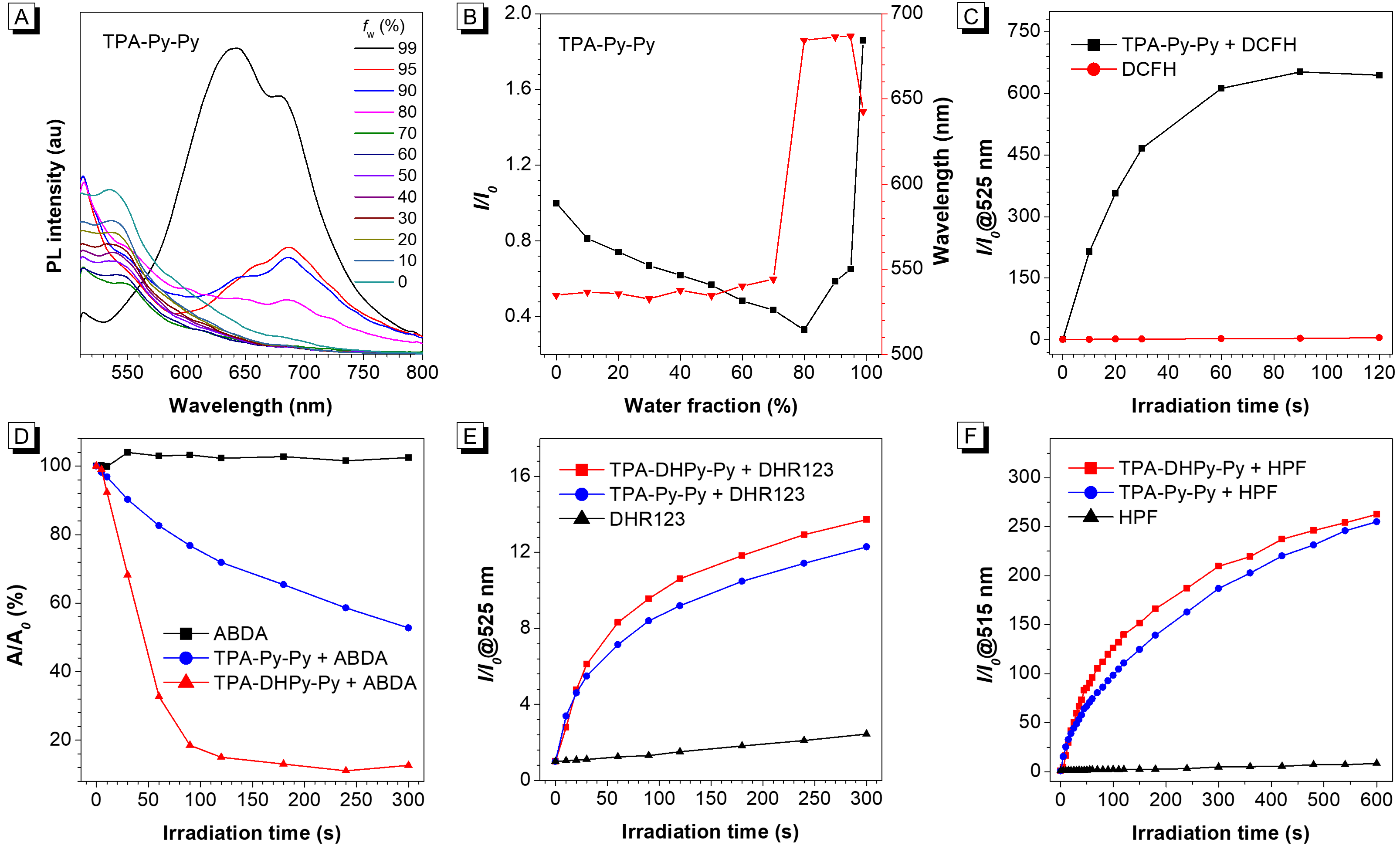
图3(A)TPA-Py-Py随THF/水混合物溶剂组分变化的PL谱图;(B)TPA-Py-Py的相对最大发射强度(I/I0)(黑线)和最大发射波长(红线)随THF/水混合物溶剂组分变化图;(C)TPA-Py-Py存在时DCFH的相对发射强度随光照时间的变化图;白光照射下,DMSO/PBS(v/v = 1/99)共溶剂中存在TPA-DHPy-Py或TPA-Py-Py时(D)ABDA的相对吸收强度和(E)DHR123和(F)HPF的相对PL强度变化图

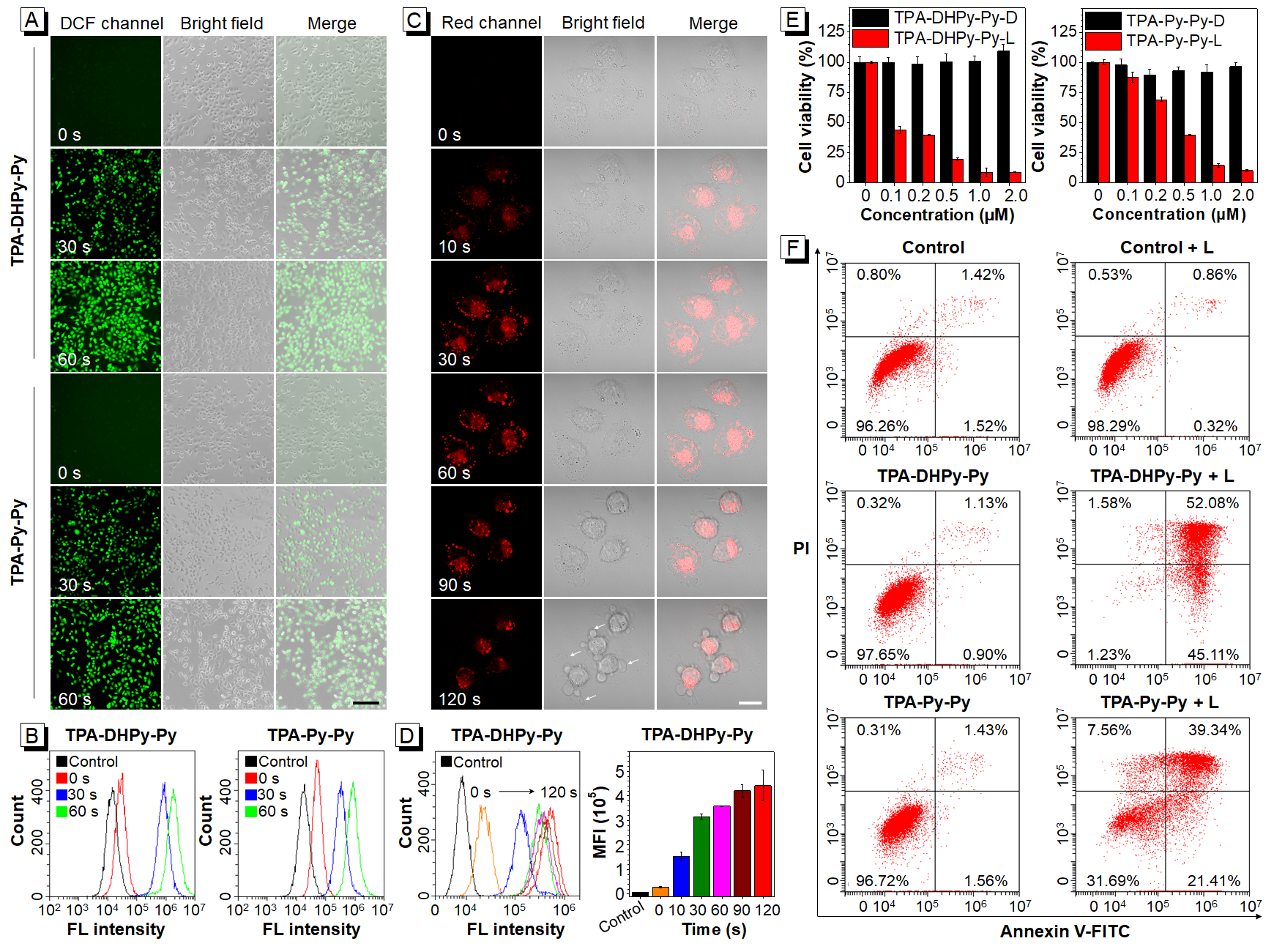
图5(A-B)经TPA-DHPy-Py和TPA-Py-Py分别处理的MDA-MB-231细胞在不同光照时间下的ROS生成情况;(C-D)经TPA-DHPy-Py处理的MDA-MB-231细胞在不同光照时间下光激活成像情况;(E)经不同浓度的TPA-DHPy-Py和TPA-Py-Py分别处理的MDA-MB-231细胞的存活率;(F)经TPA-DHPy-Py和TPA-Py-Py分别处理的MDA-MB-231细胞在光照前后的凋亡率
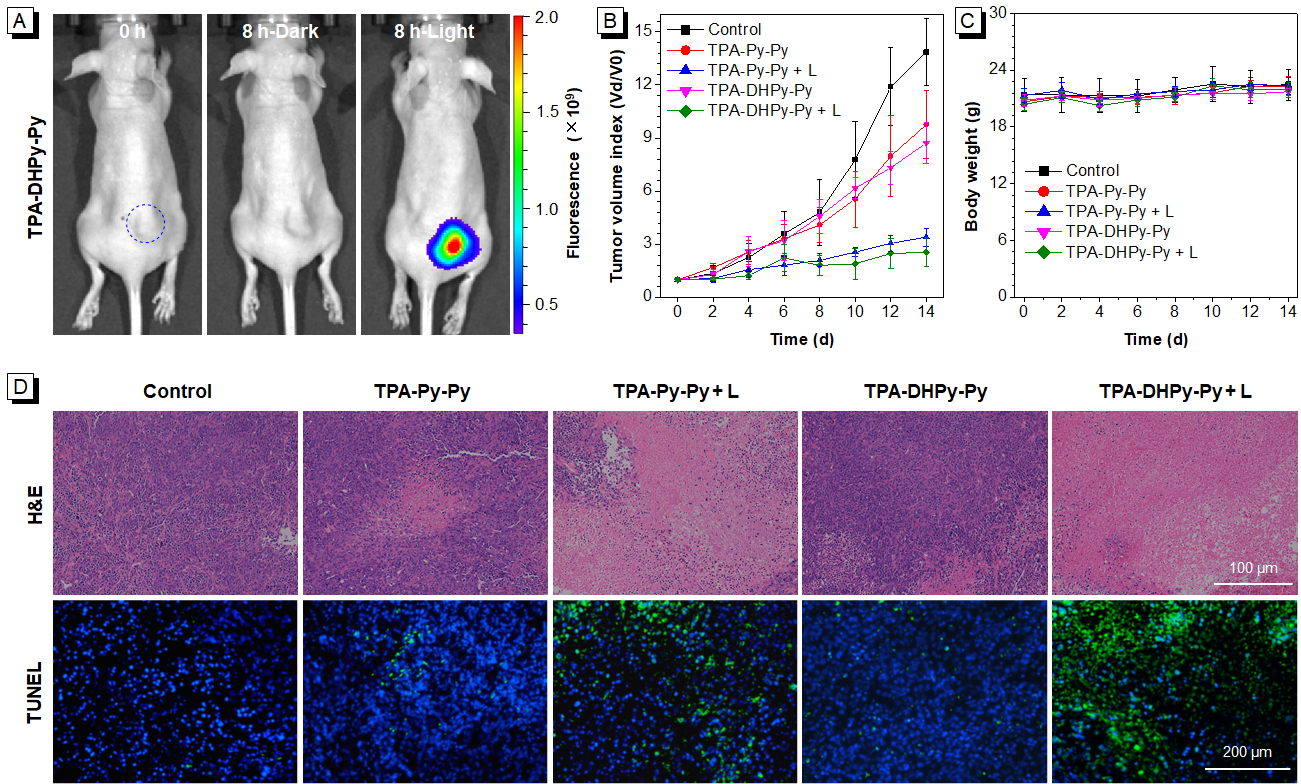
图6(A)经TPA-DHPy-Py处理的荷瘤裸鼠不同时间点的成像情况;(B)治疗过程中荷瘤小鼠的肿瘤体积变化;(C)治疗进程中的荷瘤小鼠的体重变化;(D)治疗14天后的荷瘤小鼠的肿瘤切片的H&E和TUNEL染色图
论文链接:https://doi.org/10.1002/adfm.202211571
- 南林蔡旭敏、港中深唐本忠/汪文锦团队 AFM: 松香基天然电子受体构建TICT活性的双功能BioAIE材料 2025-07-22
- 唐本忠教授/林荣业教授团队、胡连瑞研究员 Nat. Commun.:变色龙聚集诱导发光分子在光、热调控下六重稳定态的可控转换 2025-07-11
- 香港中文大学(深圳)唐本忠院士/赵征教授团队《ACS Nano》:细胞膜靶向的聚集诱导发光分子用于神经追踪和损伤的可视化 2025-01-21
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
