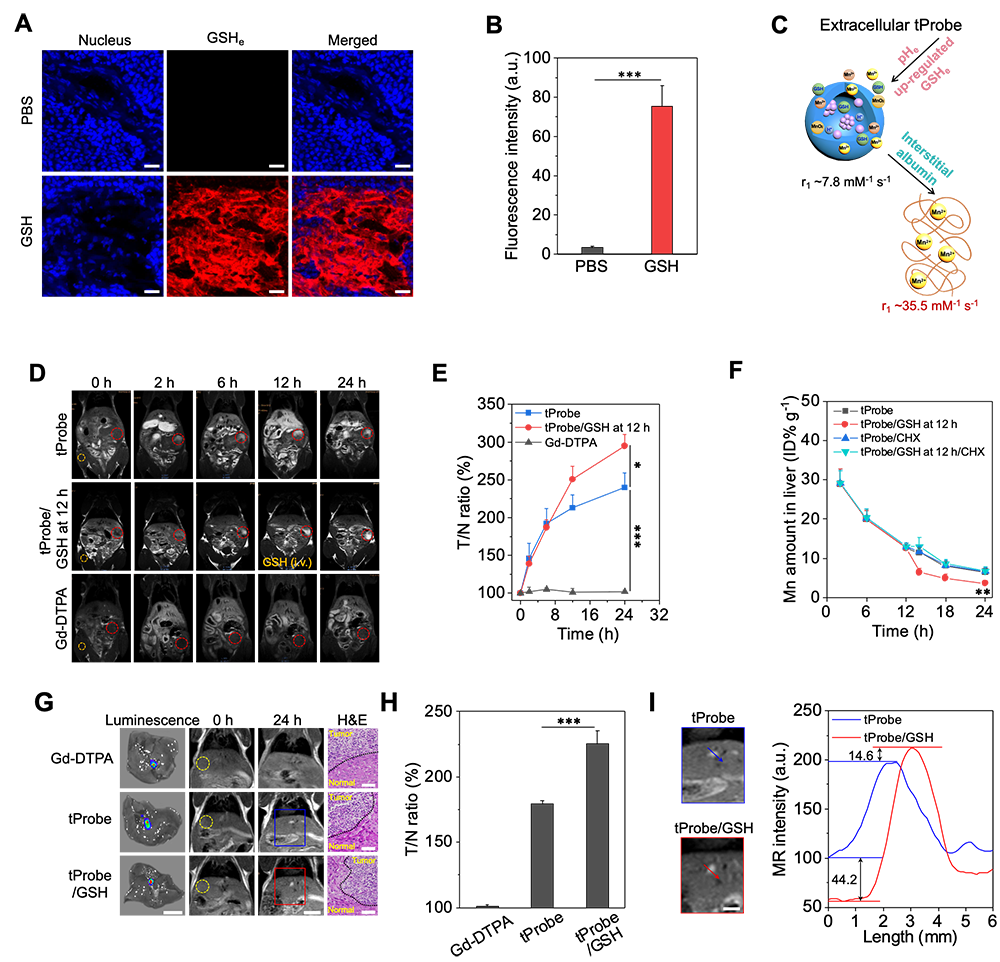
肿瘤磁共振成像对于肿瘤监测、疗效评估、手术导航有重大意义,利用造影剂提升肿瘤成像对比度是临床常用策略,但现有造影剂存在着肿瘤选择性差、成像对比度低等缺陷。近年来,利用肿瘤部位特殊微环境特征(如微酸性、胞内高浓度谷胱甘肽GSH、过表达酶或蛋白等)设计的智能响应性造影剂能有效提升肿瘤成像对比度,但响应性造影剂的激活通常仅发生于肿瘤细胞内局部位置(如富集GSH的胞浆或溶酶体、酸性溶酶体),而肿瘤基质中则缺乏相关的刺激信号,反之亦然。同时,正常组织中造影剂引起的背景噪音,也严重限制了肿瘤成像的对比度。因此,发展具有高对比度肿瘤成像功能的新型磁共振探针是当前肿瘤成像研究的重点和难点。

图1:智能响应性磁共振纳米探针的肿瘤全息成像机制示意图
1.靶向性智能纳米探针的构建及其响应行为的精准测定

2.靶向性智能纳米探针通过胞内响应成像特性显著提升造影对比度

3.外源性GSH注射介导胞外信号激活和非靶探针快速清除实现超高对比度的全息成像效应
论文信息:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202209603
T. Li, X. Tan, X. Liu, M. Li, J. Luo, Y. Zhang, Z. Jiang*, Y. Deng, L. Han, H. Ke, J. Shen, Y. Tang, F. Liu, H. Chen*, T. Yang*, Adv Mater, 2022, doi: 10.1002/adma.202209603
通讯作者信息:

杨涛,苏州大学药学院特聘教授、博导。2018年于苏州大学获得药剂学博士学位,随后前往Innovation center of nanomedicine从事博士后研究(合作导师:美国科学院外籍院士、东京大学Kataoka教授)。杨涛博士于2021年加入苏州大学药学院,主要从事智能药物递送及免疫创新制剂的研究,作为通讯作者/第一作者在领域内高水平期刊Nat Biomed Eng、Adv Mater、ACS Nano、Biomaterials、J Controlled Release、Theranostics等发表SCI论文10余篇,其中ESI高被引论文2篇;获已授权国际/国内专利5项。作为项目负责人承担了国家自然科学基金委、日本学术振兴会、江苏省双创计划、姑苏创新创业领军人才等科研及人才项目。

陈华兵,苏州大学药学院特聘教授、博导,副院长,2012年回国后,建立了“纳米药物与分子影像”研究室,团队现有教授3人、副教授4人及研究生20余人。作为课题负责人,承担了科技部国家重点研发计划课题、国家自然科学基金杰出青年科学基金(2021年)、优秀青年科学基金(2014年)、面上项目、青年基金、江苏省“双创计划(2014年)、姑苏创新创业计划创新领军人才等国家及省市项目。迄今为止,已发表SCI论文70余篇,其中在Adv Mater, ACS Nano, Biomaterials, J. Control. Release等IF>10的期刊上发表通讯作者论文30余篇,ESI高被引论文10余篇。被选为中国药学会纳米药物专业委员会委员、中国抗癌协会纳米肿瘤学专业委员会常务委员等。
- 苏州大学汪晓巧教授《Nat. Commun.》:仿生蛛丝再突破!湿纺技术制备高性能水凝胶纤维 - 兼具高强韧性与智能响应性 2025-12-03
- 清华大学李琦课题组诚聘博士后 - 材料、化工、电气 2025-10-27
- 电子科大王东升/郑永豪团队《Chem. Soc. Rev.》综述:材料如何响应光的指令 2025-07-10
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
