
纳米药物已经广泛应用于肿瘤临床治疗,但是网状内皮系统的快速清除严重限制了其治疗效果。网状内皮系统阻塞(RES-blockade)策略可以暂时性地、可逆地延缓肝脏清除,提高纳米药物的肿瘤富集以及抗肿瘤作用,具有良好的生物安全性。然而,循环系统中大量的纳米颗粒仍然会对网状内皮系统带来额外的负担,因此提高RES-blockade策略效率尤为重要。研究表明,RES-blockade策略的效率受到多种因素的影响,包括阻塞与给药的时间间隔、阻塞剂量以及阻塞材料的理化性质等。纳米颗粒的力学性能显著影响纳米药物体内递送的五个关键过程,包括血液循环、肿瘤富集、深部穿透、细胞摄取以及药物释放,然而对RES-blockade策略效率以及巨噬细胞功能的影响尚不清楚。
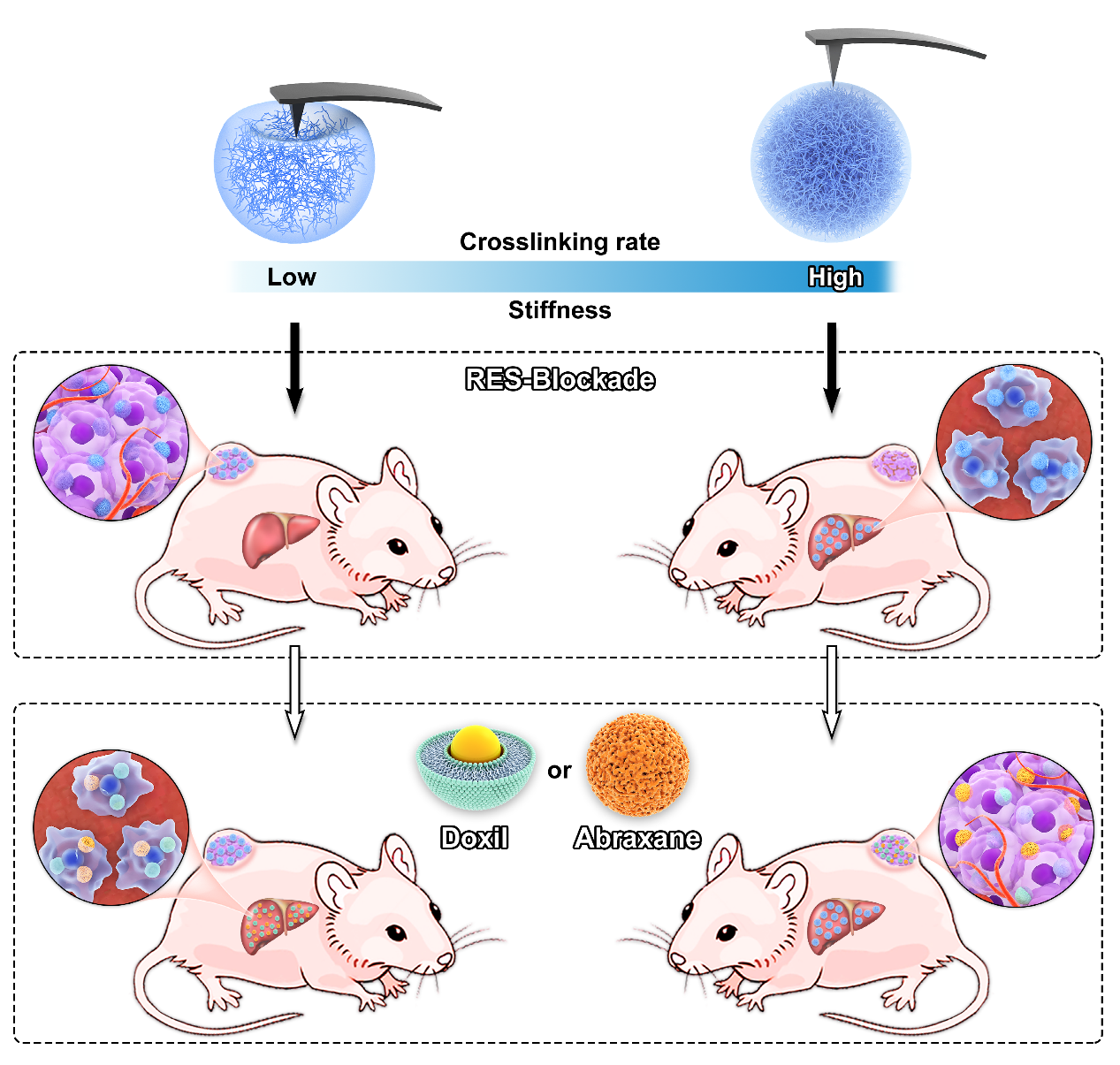
图1. 力学赋能纳米药物抗肿瘤作用策略示意图
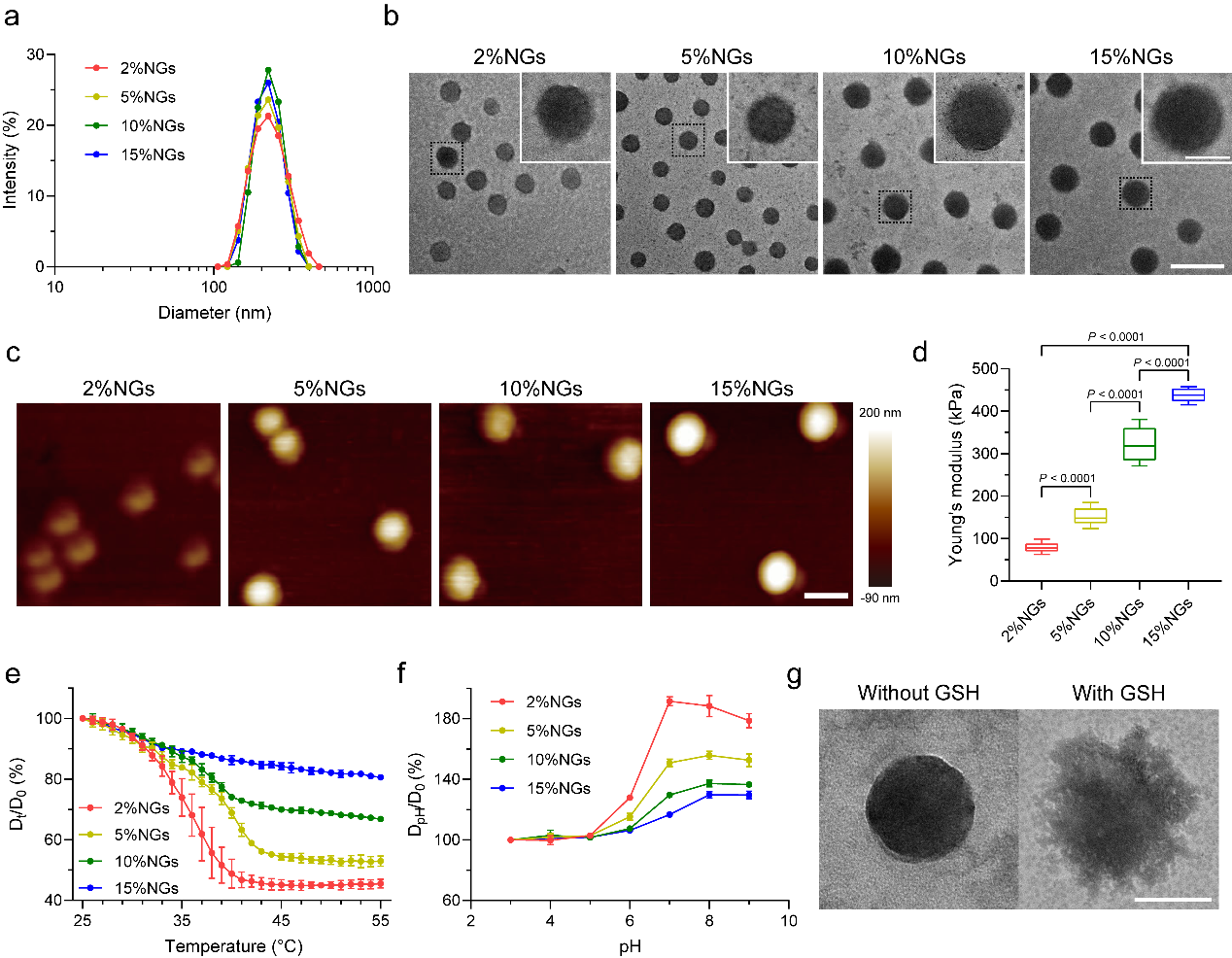
图2. 不同硬度纳米凝胶的制备与表征
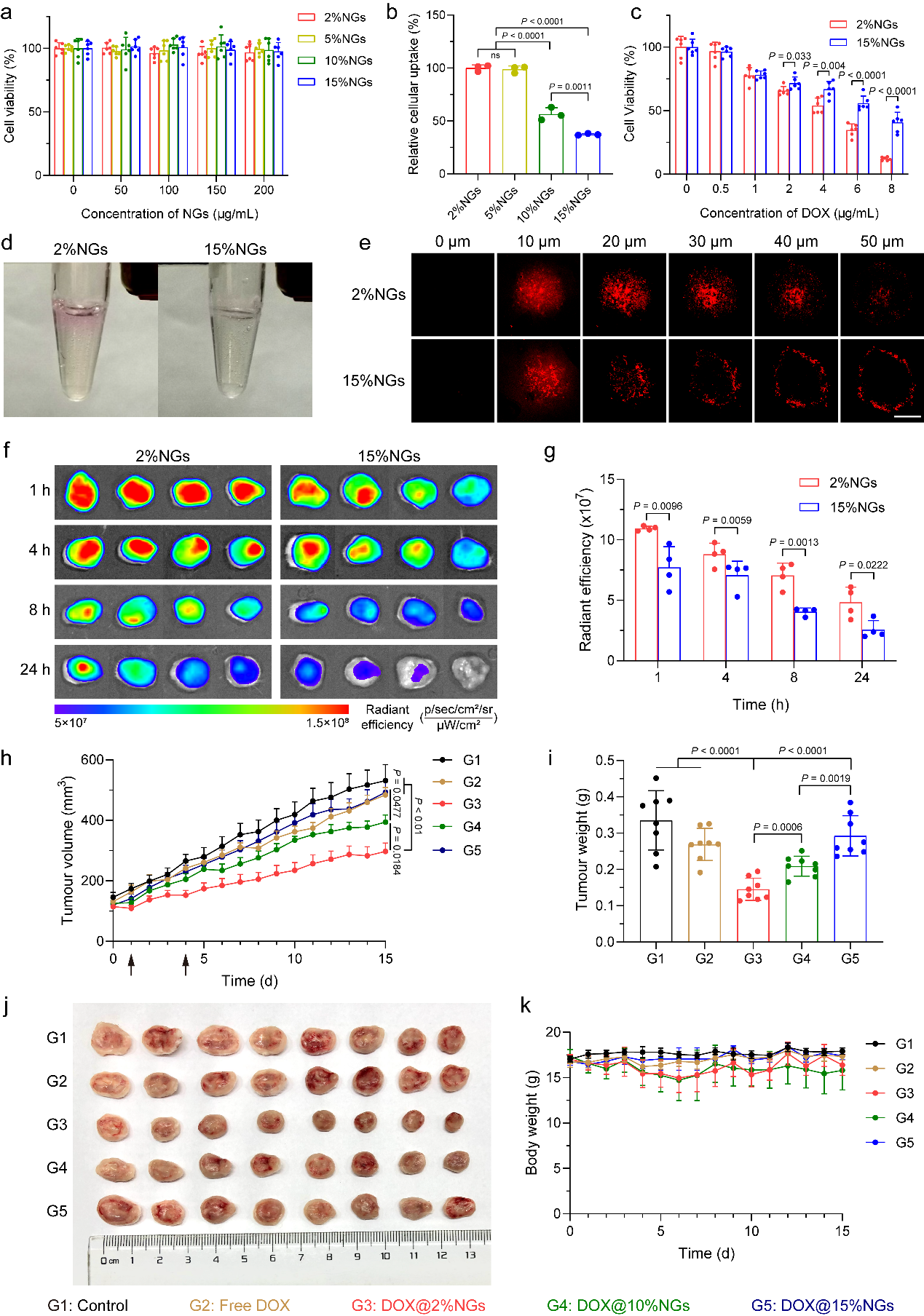
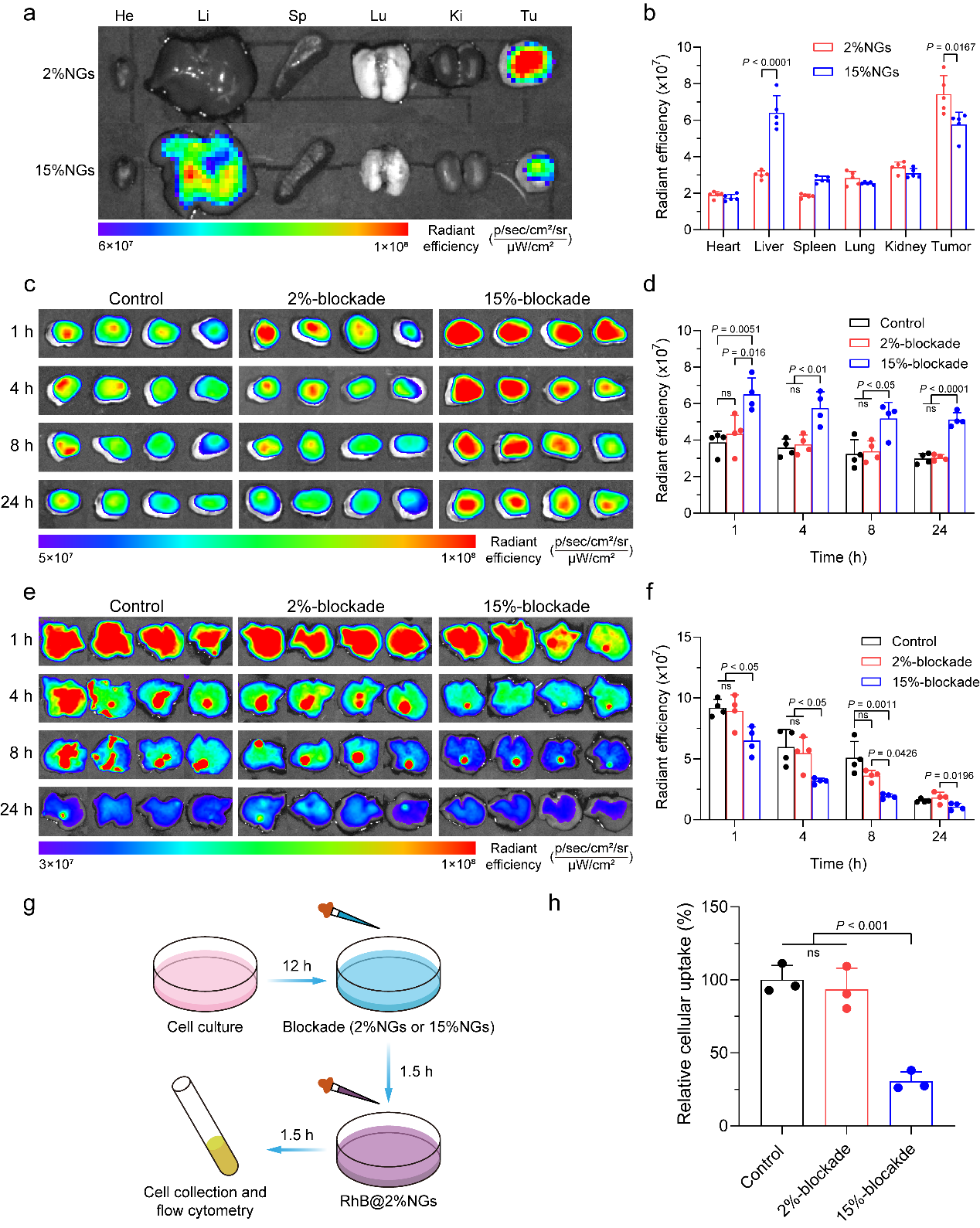
图4. 硬质纳米凝胶具有更高的网状内皮阻塞效率
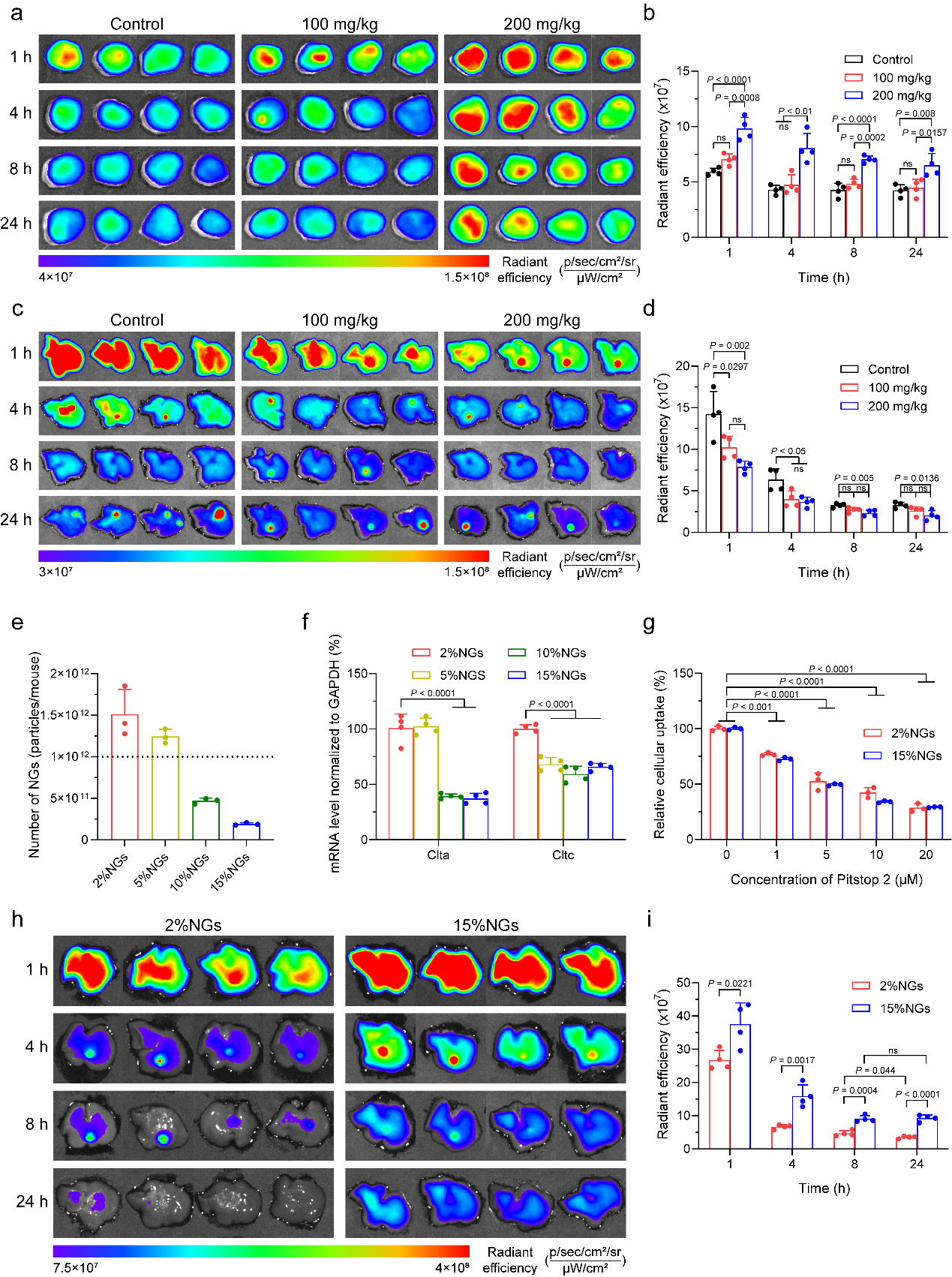
图5. 纳米凝胶力学性能是影响RES-blockade策略效率的关键因素
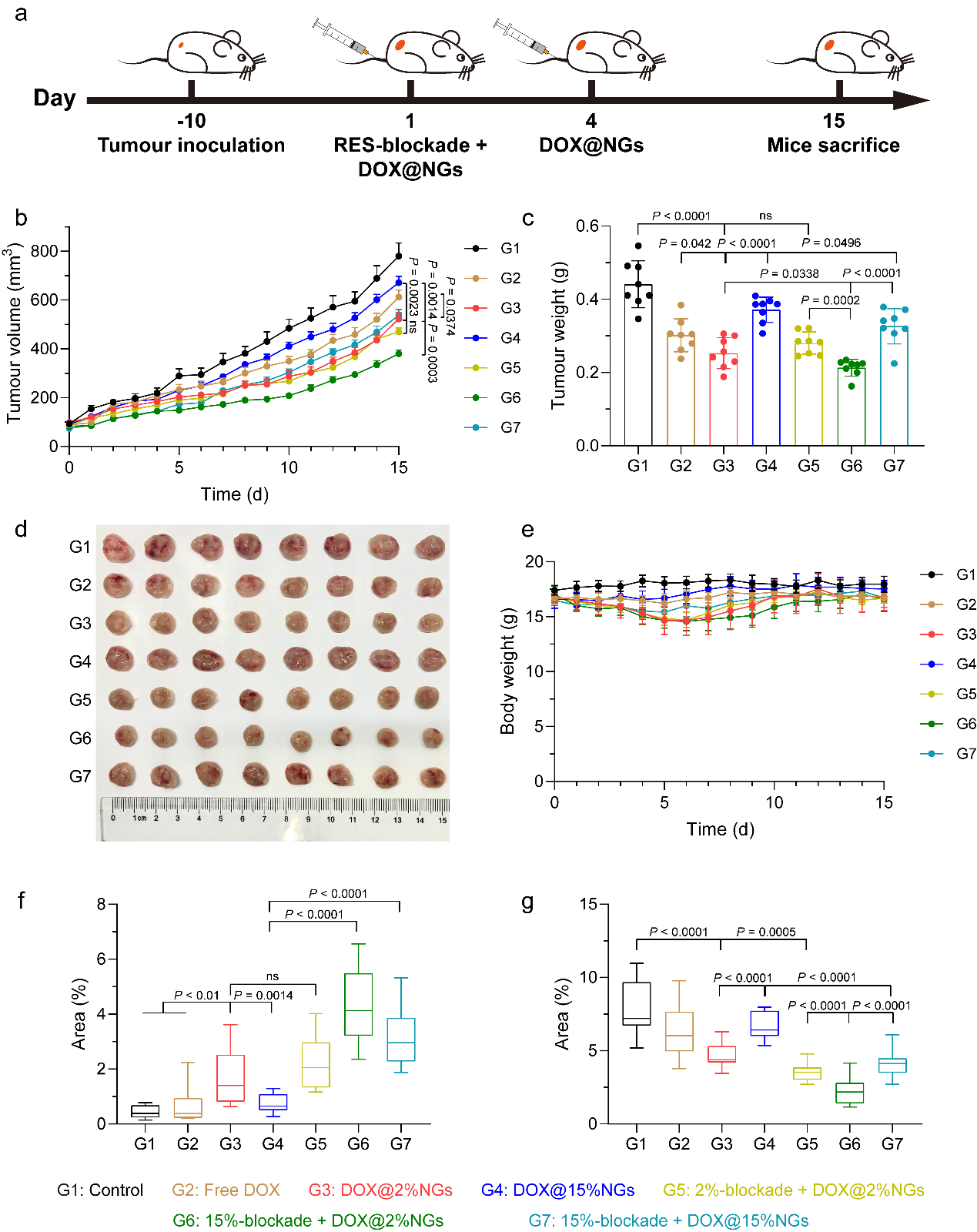

图7. 基于硬质纳米凝胶的RES-blockade策略可以促进上市纳米药物抗肿瘤作用
以上研究成果以“Mechano-boosting nanomedicine antitumour efficacy by blocking the reticuloendothelial system with stiff nanogels”为题,发表在《Nature Communications》(DOI:10.1038/s41467-023-37150-3)上。华中科技大学生命科学与技术学院博士研究生李峥为文章第一作者,李子福教授为论文通讯作者。
论文链接:https://www.nature.com/articles/s41467-023-37150-3
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
- 山东大学栾玉霞教授团队 Nat. Nanotech.:发现解决CAR-T细胞疗法实体瘤疗效受限的有效方法 2025-05-20
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
