器官损伤可能危及生命,全世界每年有500多万人因此死亡。自体移植和异体移植被认为是器官移植的金标准,但仍然存在许多局限性,如供体短缺、供体部位发病率和不良免疫反应。组织工程技术的发展为器官损伤的治疗提供了新的途径。原位组织再生相对简单,通过在缺陷处植入生物支架,作为人工微环境并提供结构支持,直到组织形成。然而,原位组织再生受到原位制造技术的阻碍。原位生物打印技术可在缺损伤口上直接制备支架,为原位组织再生提供了一种新的方法。然而,由于现有的原位生物制造技术(包括打印深度和生物墨水)的限制,在体内深层器官中生物打印支架仍然是一个巨大的挑战。华中科技大学臧剑锋团队在2021年首次提出将磁控软体机器人的优势应用于3D打印,结合磁场高穿透性与软材料的大变形特点,由磁场将外部路径的运动映射到具有大变形能力的软体机器人上。通过非接触式3D打印,实现磁控3D打印(Nat. Commun. 12,5072(2021))。然而,原位组织再生需要合适的生物墨水进行原位打印,打印出与缺损几何形状匹配的更复杂的打印图案,以此来实现完全占据缺损部位的解剖结构,提供微环境和结构支持。


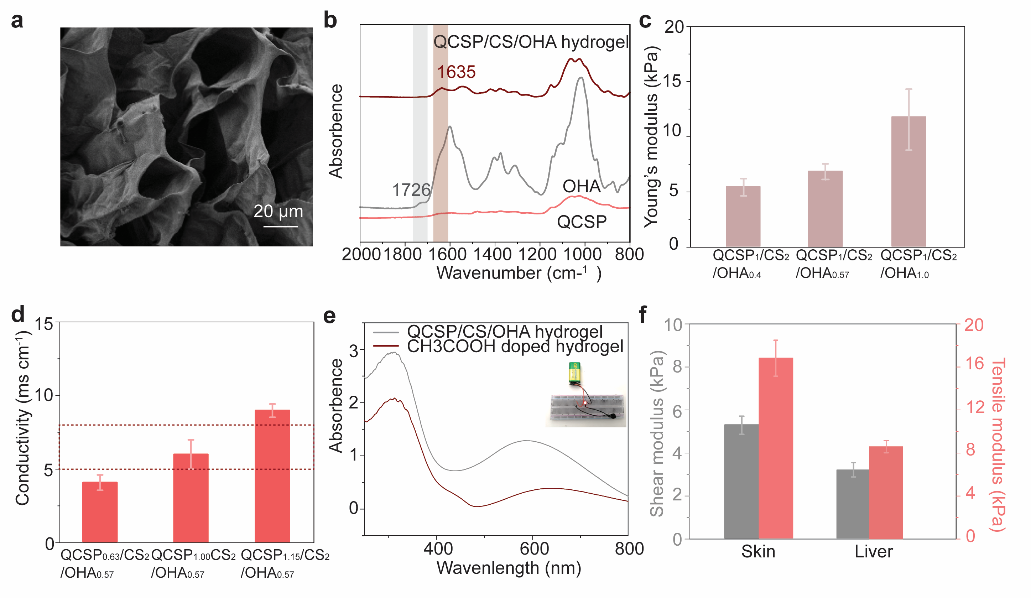
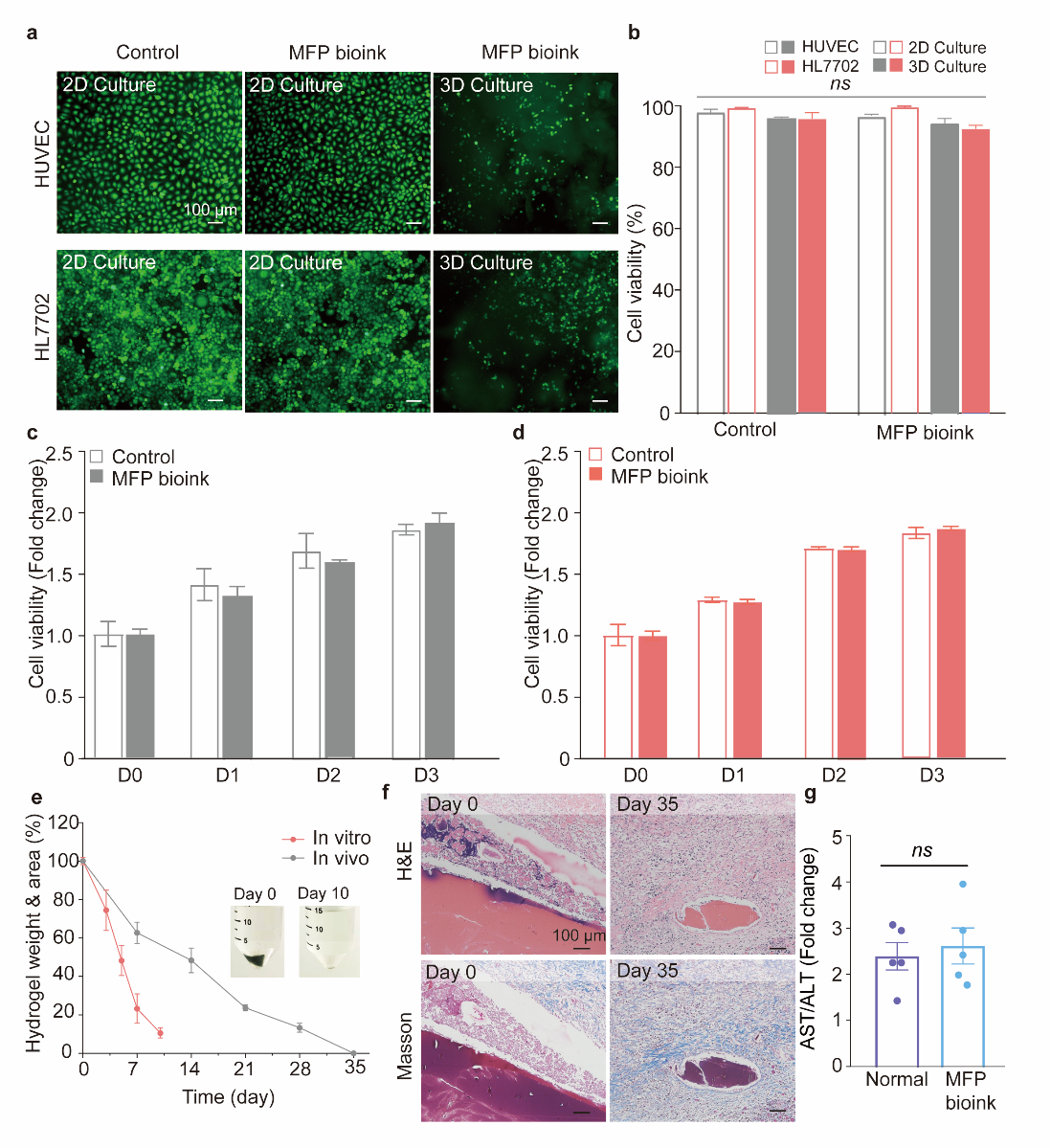
图3 导电水凝胶生物墨水的生物相容性与生物降解性
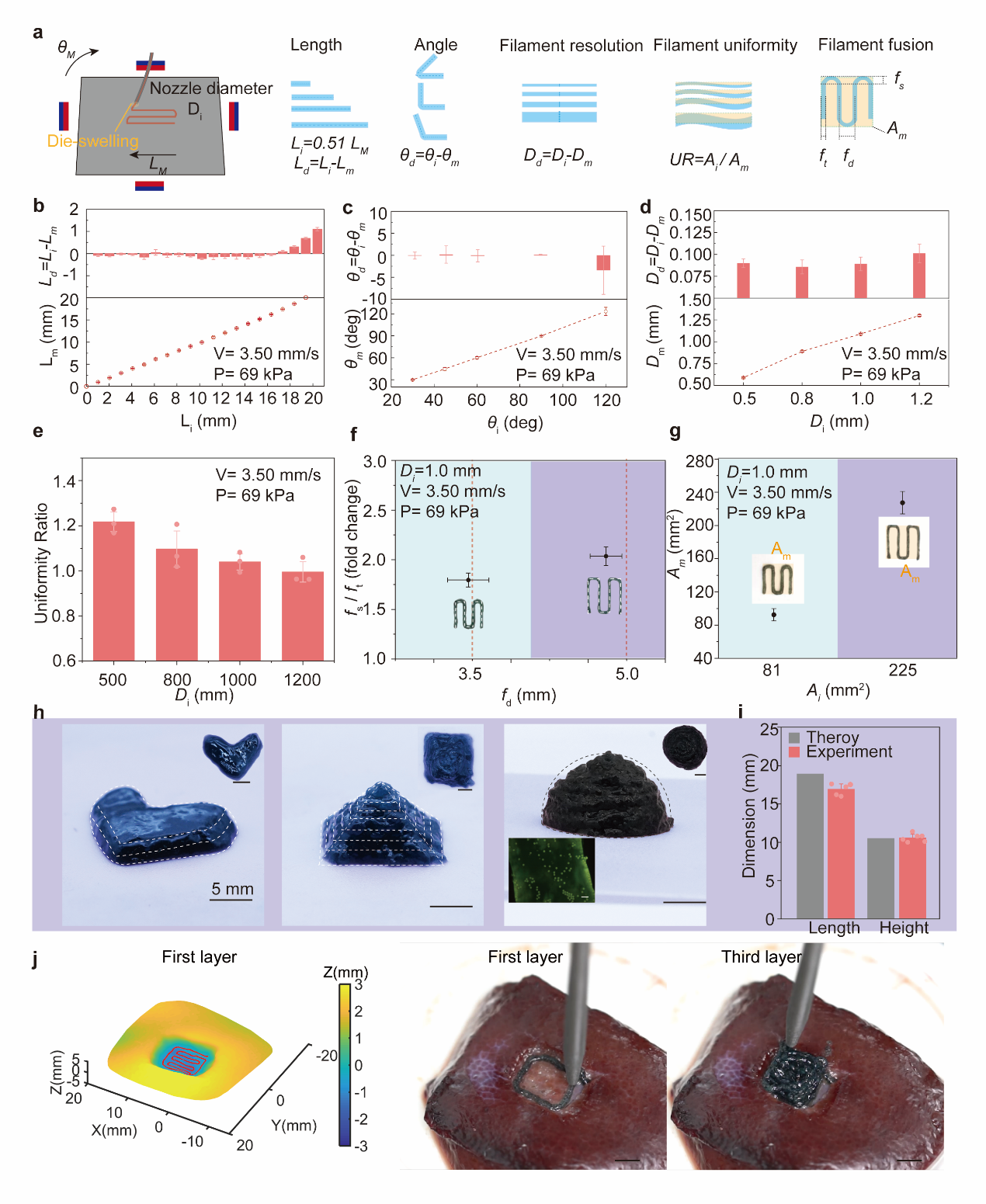
图4 导电水凝胶生物墨水的原位生物打印性能优化


图6 微创铁磁生物打印用于大鼠部分肝切除模型的原位组织再生。
这种体内支架制造技术可扩展到3D打印负载细胞的组织结构,可能为原位组织再生和体内器官培养开辟了一条新的途径。
华中科技大学博士研究生杨月莹、硕士研究生于正阳、博士研究生路小欢为本文的共同第一作者,华中科技大学臧剑锋教授、华中科技大学同济医学院附属协和医院王征教授、王琳教授为共同通讯作者。
论文链接:https://doi.org/10.1016/j.bioactmat.2023.03.011
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 大连工业大学郭静/张森教授团队 Macromolecules:多重相互作用形成的有序纳米结构用于增韧超拉伸导电水凝胶 2025-11-10
- 中山大学付俊/南京林业大学韩景泉 AFM:基于Hofmeister效应的各向异性、抗溶胀导电水凝胶用于水下监测 2025-11-07
- 西南交大王勇教授等 Macromolecules:受生物矿化启发的超强韧自愈合水性聚氨酯弹性体 2025-10-03
- 深圳技术大学史济东等 Carbon:基于石墨烯-纳米纤维素复合薄膜的自修复应变/湿度双模传感器的设计及在可穿戴呼吸监测的应用 2025-05-28
- 韩国KAIST应邬彬、宁波材料所朱锦 Macromolecules:红海星启发的水下自愈材料突破 2025-04-29
- 苏大孙立宁教授团队王凤霞课题组 ACS AMI:基于碳化丝纳米纤维的可降解型生物兼容的温度传感器-实现细胞外环境温度的实时检测 2022-04-26
