智能医疗传感器(SHSs)是以患者为中心的诊断监测设备之一,它们能够以无创方式捕获实时生理信号,如心电信号、血压和肌电信号等。作为薄膜基SHSs的关键因素,导电元件在制备SHSs中受到了广泛的关注,特别是镓铟合金和聚(3-己基噻吩-2,5-二基),它们具有突出的可拉伸性、可调节的电导率和高的灵敏度。然而,较差的自愈性能、不理想的皮肤粘附性以及较低的水下电稳定性严重限制了它们的进一步应用,甚至在一些急性或高要求的情况下导致生理信号检测结果不可靠。
鉴于此,福州大学石油化工学院张进教授提出了一种由聚(3-己基噻吩-2,5-二基)/丁基橡胶(P3HT/BR)、镓-铟共晶合金(E-Galn)和聚二甲基硅氧烷-P3HT/BR(P-P3HT/BR)组成的新型薄膜基SHSs,用于高性能心电信号监测。
由于BR的粘度特性和低玻璃化转变温度、P3HT原纤维的相互连接和E-Galn共同赋予了SHSs高自修复效率,能够自主修复机械和电性能损失。SHSs与皮肤之间存在范德华力和摩擦力,从而表现出适度的皮肤粘连和无痛脱离,有效地防止了粘连引起的刺激。此外,SHSs由于暴露在空气的一面具有优异的防水性而满足了其水下的电灵敏和稳定性能,这一点通过猪和人在大量水生动态的电生理信号监测数据中得到了验证。这些结果表明,作为一个多功能平台,SHSs不仅为医疗保健监控提供了精确和实时的信息,而且为促进下一代传感器的开发提供了有价值的指导。该研究以题为“Smart Healthcare Sensor with Dual Autonomous Self-Healing, Repeatable Skin Adhesion/Detachment, and Hydrophilic/Hydrophobic Janus Surface for Aquatic Ambulatory Electrophysiological Monitoring”的论文发表在《Chemical Engineering Journal》。
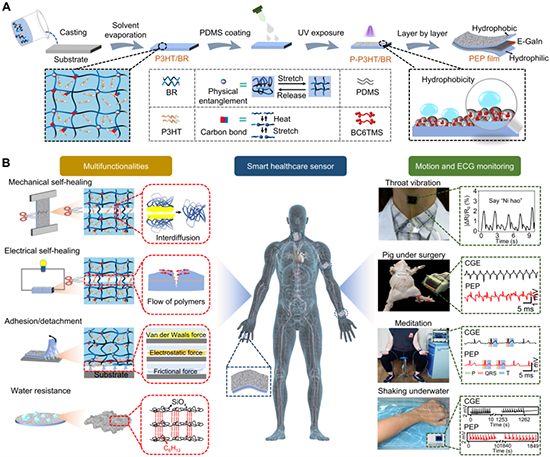
图1. PEP薄膜基传感器的制备及其在健康监测领域的应用。
【P3HT/BR薄膜的粘附和自愈合性能】
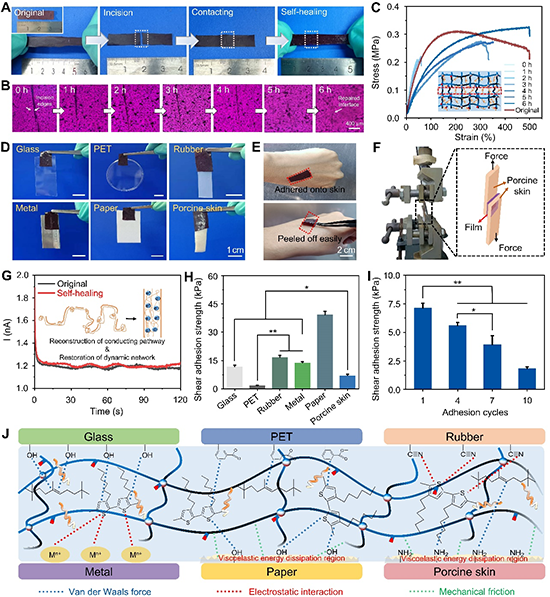
图2. P3HT/BR薄膜的自愈合、粘附性能及其机理。
P3HT/BR薄膜不仅能粘在猪皮肤组织,还可以与各种材料表面,包括橡胶、玻璃和金属等产生紧密的粘附。这主要归因于薄膜和各种底物之间存在多种物理相互作用,主要包括范德华力、静电相互作用力和摩擦力等,产生中等强度的粘附性(图2D?E&2J)。通过搭接剪切试验定量研究了P3HT/BR薄膜对不同几何形状基材的粘附强度,在所有情况下,P3HT/BR膜对纸张的粘附强度最高,为39.30 ± 1.76 kPa,与猪皮的粘附强度适中,为7.00 ± 0.70 kPa(图2H)。此外,还进行了P3HT/BR薄膜与猪皮的循环剥离粘附试验。如图2I所示,随着循环次数的增加,由于去除过程中的粘弹性能量耗散,薄膜的粘附强度逐渐下降,而在10次循环后,复合膜从皮肤组织中剥离后,仍有1.83 ± 0.15 kPa的较好粘附强度。当P3HT/BR薄膜作为SHSs时,这种适中且可重复的粘附强度保证了其与人体皮肤的合适贴合、稳定的信号传输以及佩戴的便利性。
【P-P3HT/BR膜的亲/疏水Janus表面特性】
研究人员试图制备一种具有亲/疏水Janus特性的SHSs,同时满足防潮和组织相容性的要求。如图3A所示,通过在P3HT/BR膜表面涂覆PDMS涂层,利用旋涂仪构建疏水P-P3HT/BR膜。使用SEM、XPS和FTIR观察了P-P3HT/BR膜的微观形貌、成分组成及表面结构,这些结果表明成功地形成了稳定均匀的涂层(图3B?D)。如图3E所示,这种峰状凸起的均匀粗糙结构是由有机硅烷中的长烷基桥接基团驱动的,其过程通过紫外照射时间进行调控,有利于提高P-P3HT/BR膜的疏水性。此外,P-P3HT/BR膜在pH=1?13范围内的溶液中浸泡24 h,其水接触角没有明显影响(图3F),表明P-P3HT/BR薄膜通过疏水改性具有良好的环境稳定性和耐溶剂性。
【PEP薄膜基传感器的制备及其性能表征】
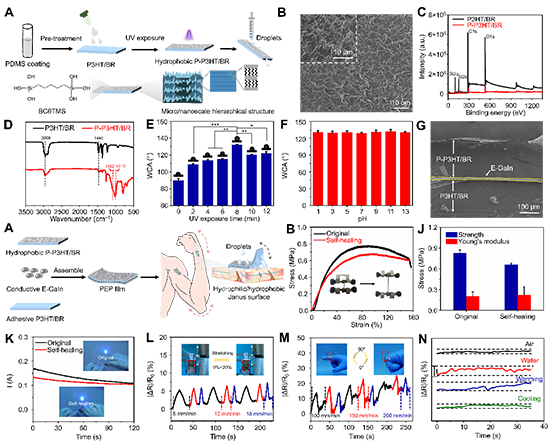
图3. P-P3HT/BR薄膜和PEP传感器的制备及性能表征。
【PEP薄膜基传感器的健康监测及体外生物相容性研究】
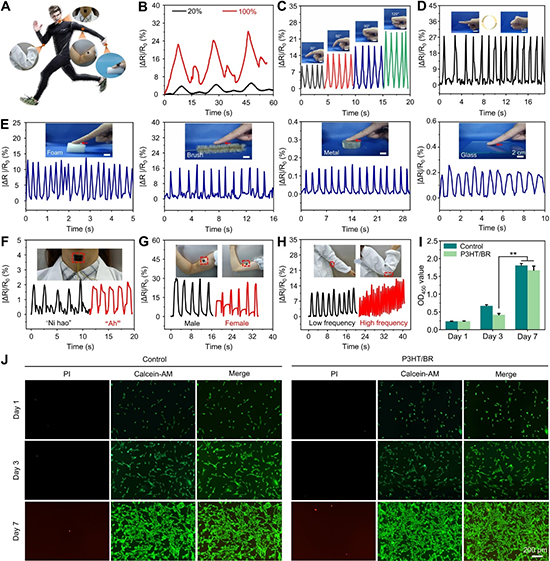
图4. PEP薄膜基传感器的健康监测及体外生物相容性研究。
【PEP薄膜传感器在心电图监测中的应用研究】

图5. PEP薄膜基传感器的心电监测应用。
该研究成果以“Smart Healthcare Sensor with Dual Autonomous Self-Healing, Repeatable Skin Adhesion/Detachment, and Hydrophilic/Hydrophobic Janus Surface for Aquatic Ambulatory Electrophysiological Monitoring”为题,近期发表于Chemical Engineering Journal。论文共同第一作者为福州大学石油化工学院硕士生王子义、石油化工学院硕士生阮任杰和福建省立医院主任医师林根辉。通讯作者为福州大学石油化工学院林小城教授和张进教授。
该工作得到国家重点研发计划项目、泉州市高层次人才创新创业计划项目、福建省卫健委科技计划医药创新项目、清源创新实验室重点项目等基金的资助。并感谢福建省雏鹰计划青年拔尖人才项目及福建省科协青年托举人才项目的大力支持。
原文链接:https://doi.org/10.1016/j.cej.2023.143603
- 东华大学游正伟教授团队JMCA封面:可任意变形且具双重自修复模式的摩擦纳米发电机 2019-06-26
- 达拉斯德克萨斯大学戴贤明教授团队 AFM:双亲类液体表面突破仿甲虫表面的冷凝极限 2023-01-12
