光热治疗(PTT)不仅通过使用光热剂将光能转化为热能来杀伤肿瘤细胞,而且还可通过损伤相关分子模式诱导免疫原性死亡(ICD)来启动抗肿瘤免疫循环响应。因此,合理设计PTT-免疫治疗联合疗法可以大大增强抗肿瘤效果。然而在PTT治疗过程中,癌细胞可以通过自噬产生的自我保护机制抵抗其造成的压力,将此过程中受损的细胞器和老化蛋白质从肿瘤细胞中清除。自噬是一个自我代谢过程,通过自噬行为,癌细胞一方面可以抵御来自各种治疗方式产生的压力,另一方面可以逃避免疫监视来获得生存。由PTT造成的细胞损伤可以通过自噬过程进行修复和逆转,帮助肿瘤细胞生存。因此,为了克服自噬造成的PTT效果减弱和免疫监视规避,非常有必要开发一种新型的组分简单的纳米药物,可在实施PTT的同时抑制癌细胞自噬机制,并将其与免疫治疗药物相结合,可达到特异性高和疗效增强的肿瘤治疗效果。
氯喹(CQ)作为一种常用的自噬抑制剂被广泛用于PTT和化疗的结合,以提高治疗的敏感性,增强肿瘤治疗效果。最近,CQ还被发现作为一种免疫调节剂,通过诱导NF-κB通道的激活,重新调控肿瘤相关巨噬细胞(TAMs)向抗肿瘤的M1型转化,以增强机体免疫反应,从而对肿瘤产生更好的杀伤力。然而,由于CQ的高毒性和低生物利用度,导致其生物医学应用受到限制。在众多纳米载体体系中,聚酰胺-胺(PAMAM)树状大分子具有独特的理化性质,已被广泛用于多个生物医学研究领域,课题组前期研究者采用PAMAM树状大分子组装修饰金纳米花(Adv. Sci., 2018, 5, 1801612)或包裹CuS纳米颗粒(Small Methods 2021, 5, 2100204;Small 2023, DOI: 10.1002/smll.202301914),用于有效的PTT或基于PTT的联合治疗。此外,树状大分子表面也可以修饰小分子光热剂吲哚菁绿(ICG)用于肿瘤PTT和联合治疗。
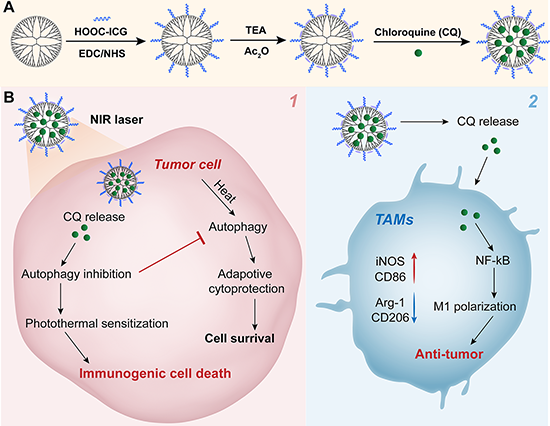
图1. GIC纳米药物制备流程(A)及其用于自噬抑制介导的增强肿瘤PTT/免疫治疗示意图(B)。
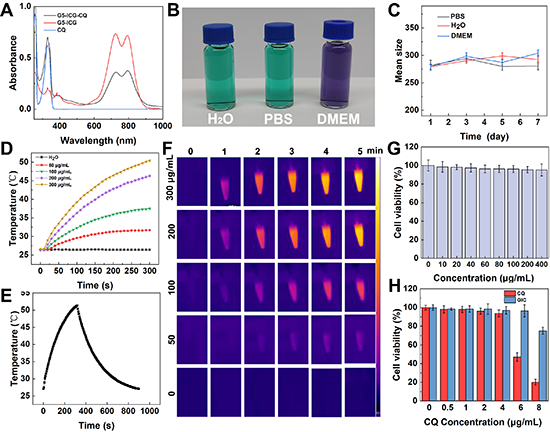
图2.(A)CQ、GI和GIC纳米药物水溶液的紫外-可见光谱;GIC纳米药物在不同介质中的第7天照片(B)和七天内的水动力学直径变化(C);(D)不同浓度的GIC水溶液在808 nm激光照射(1.2W/cm2)5分钟内的温度变化;(E)GIC纳米药物在单个循环的温度曲线图;(F)不同浓度的GIC水溶液在808 nm激光照射(1.2W/cm2)5分钟内的热成像图;(G-H)不同处理后B16-F10细胞的CCK-8活力测试结果。
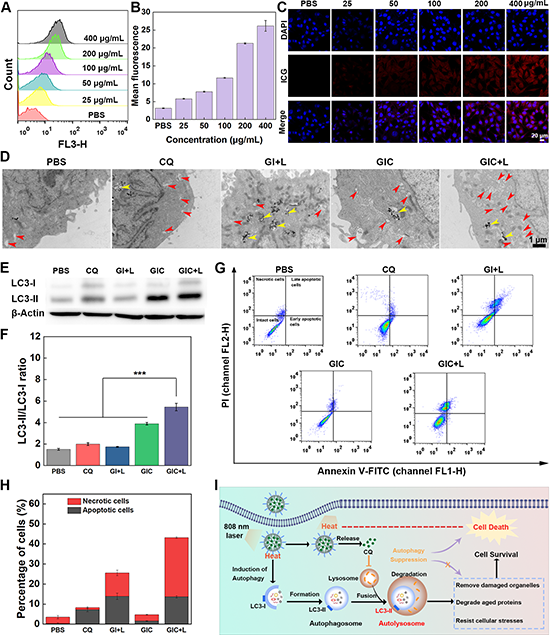
图3. (A-C)B16-F10细胞对GIC纳米药物摄取及共定位情况;不同处理后的B16F10细胞中自噬泡的生物电镜图(D)及LC3蛋白表达情况(E-F);不同处理后B16F10细胞凋亡情况(G-H);(I)抑制细胞自噬用于增强PTT效应的机制示意图。
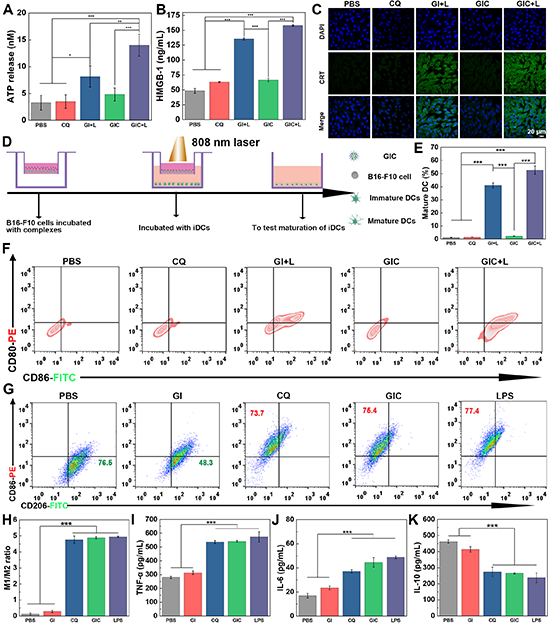
图4. 不同处理后B16F10细胞释放ATP(A)、HMGB1的水平(B)和B16F10细胞膜表面暴露CRT的水平(C);不同处理的B16F10细胞与树突细胞共孵育示意图及熟化情况(D-F);IL-4预处理的RAW264.7细胞经过不同处理后的CD86和CD206表达流式分析图(G)、M1/M2比值定量数据(H)及细胞上清液中(I)TNF-α、(J)IL-6和(K)IL-10细胞因子分泌水平。

随后,团队研究了GIC纳米药物介导的自噬抑制增强PTT并结合免疫检查点阻断治疗的联合治疗后的体内免疫响应。结果表明,GIC+L+aPD-L1联合治疗组的脾脏CD4+T细胞和CD8+T细胞的数量在所有组中是最高的,表明联合治疗可以诱导细胞杀伤性和效应性T细胞在脾脏中表达上调,调节性T细胞(Tregs)显著下调,证明通过治疗能够刺激机体产生更多的细胞杀伤和效应性T细胞,从而增强抗肿瘤治疗效果。由于联合治疗在原发性荷瘤小鼠中具有良好的抗肿瘤治疗效果,团队进一步通过在小鼠左右两侧建立远端和原发性双侧B16F10肿瘤模型,进一步评估了体内免疫反应是否能抑制远端肿瘤的生长。结果表明,PBS对照组的小鼠远端肿瘤生长迅速,而GIC+L或GIC+L+aPD-L1治疗组可以明显抑制远端肿瘤生长,其中GIC+L+aPD-L1组表现出最佳的远端肿瘤抑制效果(图6A-E)。此外,流式细胞术分析结果表明,GIC+L+aPD-L1组表现出最高的脾脏CD4+T细胞和CD8+T细胞种群以及最少的免疫抑制性调节T细胞Tregs(图6F-J)。
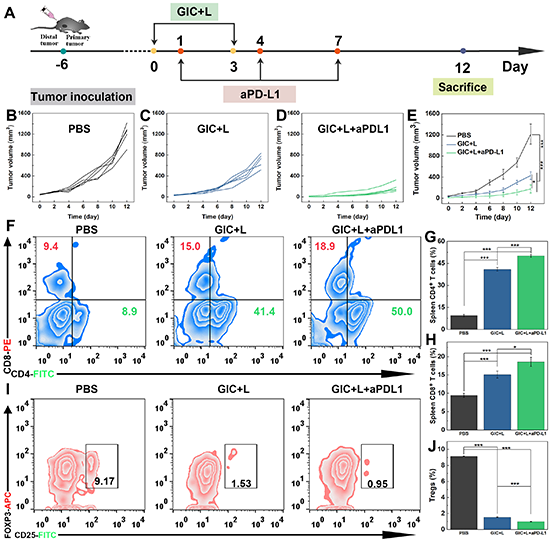
图6. (A)双侧B16F10小鼠肿瘤模型体内治疗过程示意图;(B-E)不同时间段内小鼠肿瘤体积变化。(F-J)远端B16F10肿瘤小鼠经不同治疗后脾脏中的CD4+/CD8+ T细胞和Tregs细胞流式分析图。
论文链接:https://doi.org/10.1016/j.nantod.2023.101936
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中科大王育才/蒋为团队 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破肿瘤血管基底膜屏障,增强纳米药物瘤内递送 2025-05-03
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
