
尽管免疫治疗与其他治疗方法的结合为肿瘤治疗提供了可能性,但癌症治疗后免疫抑制通路的上调仍严重影响治疗效果。针对这个问题,东华大学李静超团队设计了一种用于癌症免疫治疗的声激活型半导体聚合物纳米反馈剂(SPNSA)对上调的免疫抑制通路进行双重调控。SPNSA包含半导体聚合物纳米颗粒(SPN)作为声敏剂、腺苷受体A2A拮抗剂(SCH58261)、程序性死亡配体1(PD-L1)抗体(aPD-L1)和单线态氧(1O2)响应型片段(如图1)。在超声(US)作用下,SPN产生1O2用于声动力疗法(SDT)和诱导免疫原性细胞死亡(ICD),同时上调腺苷水平和PD-L1表达。此外,产生的1O2可切断1O2响应型片段,实现SCH58261和aPD-L1的按需释放。释放的SCH58261和aPD-L1作为反馈剂,同时缓解上调的免疫抑制腺苷和PD-L1途径,从而进一步扩大抗肿瘤免疫效应。在双侧荷瘤小鼠模型中,SPNSA联合超声激活能显著抑制肿瘤的生长和转移。因此,本研究提供了一个声激活型纳米平台用于通过反馈调节治疗后的免疫抑制通路以精确扩大免疫治疗效果。

图1. (a)通过纳米共沉淀和表面修饰构建SPNSA;(b)超声激活SPNSA诱导ICD、免疫抑制途径双调控和SDT联合免疫治疗的机制示意图。
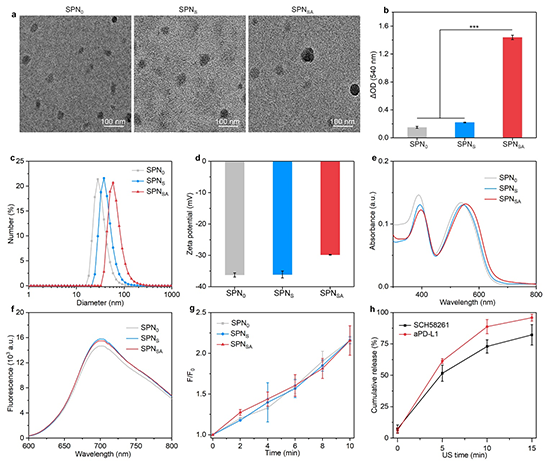
图2. (a) SPN0、SPNS和SPNSA的TEM图像;(b) SPN0、SPNS和SPNSA中蛋白质含量测量;(c) SPN0、SPNS和SPNSA的水动力学直径;(d) SPN0、SPNS和SPNSA的表面Zeta电位;(e) SPN0、SPNS和SPNSA的吸收光谱;(f) SPN0、SPNS和SPNSA的荧光性质;(g)通过测量SOSG探针的荧光强度评估1O2的产生;(h)声激活后SCH58261和aPD-L1的累积释放率。
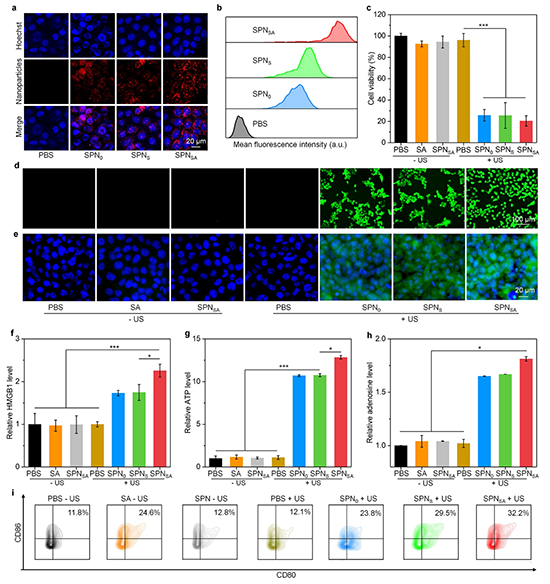
图3. (a)细胞与SPN0、SPNS和SPNSA孵育后的荧光图像(红色荧光信号来源于PFODBT,蓝色细胞经Hoechst染色);(b)体外纳米颗粒吞噬的流式细胞术分析;(c) 4T1细胞存活率分析;(d)纳米颗粒和US共处理后4T1细胞内ROS产生评估;(e)免疫荧光染色分析细胞表面CRT水平;(f) 4T1细胞经纳米颗粒和US共同处理后分泌HMGB1的水平;(g)不同处理的4T1细胞分泌ATP分析;(h)不同处理的4T1细胞中腺苷水平分析;(i)成熟DCs的流式细胞仪分析。
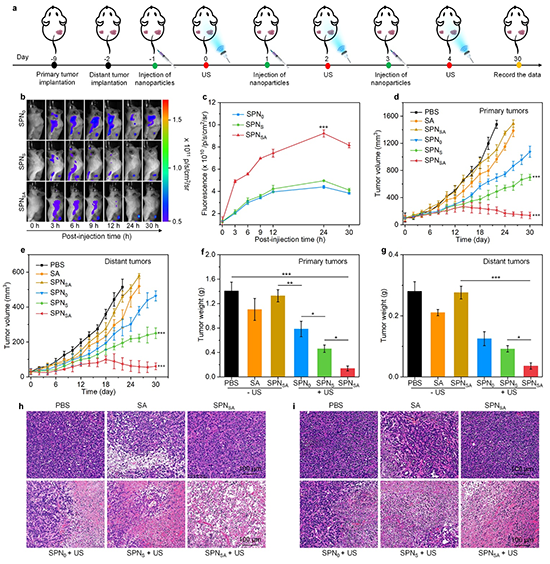

图5. (a)肿瘤引流淋巴结DC成熟的流式分析;(b)各组成熟DCs的百分比;(c)原发肿瘤中的CD4+和CD8+T细胞的流式分析;(d)原发肿瘤中CD4+和CD8+T细胞的水平;(e)远端肿瘤中的CD4+和CD8+T细胞的流式分析;(f)远端肿瘤组织中CD4+和CD8+T细胞的水平;(g-h)原发肿瘤(g)和远端肿瘤(h)中的Treg细胞的流式分析;(i)双侧肿瘤中Treg细胞的水平。
原文链接:https://www.sciencedirect.com/science/article/pii/S1748013223001937?dgcid=coauthor
- 东华大学李静超《Adv. Sci.》:声激活半导体聚合物纳米整形器多重重塑肿瘤微环境用于原位胰腺癌有效免疫治疗 2023-10-29
- 东华大学李静超课题组《Adv. Mater.》:声激活型纳米药物伴侣扩大免疫原性细胞死亡和缓解骨髓来源抑制细胞实现免疫治疗 2023-05-15
- 东华大学李静超 Angew:半导体聚合物纳米反应器通过超声触发级联乳酸消耗用于胰腺癌铜死亡-免疫治疗 2024-05-07
- 东华大学李静超 Angew:双靶向仿生半导体聚合物纳米复合物用于骨转移瘤增强型诊疗 2023-11-29
- 湘潭大学陈盛团队《Adv. Funct. Mater.》:基于P型半导体聚合物填料构建物理交联和电子-空穴对提升高温储能 2023-11-14
- 温医大纪建松/苏大刘庄、冯良珠 Adv. Sci.:肿瘤碎片驱动的胆固醇靶向催化水凝胶可增强微波消融联合抗肿瘤免疫反应疗效 2024-12-16
- 澳门大学代云路 Angew:具有细胞器水平精度的金属酚纳米材料通过mtDNA依赖的cGAS-STING通路激活启动抗肿瘤免疫 2024-09-09
