近期,四川大学华西医院国家老年疾病研究中心刘瑾副教授、西南交通大学医学院(生物医学工程研究院)谢超鸣研究员在ACS Nano上联合发表研究文章:针对糖尿病牙周炎的牙周组织修复困难,设计了一种聚多巴胺(PDA)介导的超长丝微纤维(PDA- msf)和二甲双胍(Met)负载的沸石咪唑盐框架(ZIF),并将他们结合到丝素/明胶(SG)贴片中,期望通过PDA和Met的免疫调节能力改善炎症微环境来促进牙周软硬组织再生。该复合贴片具有机械柔韧性和持续的药物释放特性,十分符合临床牙周手术的力学标准和方便性要求。还具有良好的组织亲和性、抗氧化和抗炎特性;能对抗高糖炎症环境造成的牙周膜干细胞衰老并促进其成骨分化。调控巨噬细胞极化方向进而促进成骨相关细胞因子的分泌和免疫调节活性。通过减轻炎症、减轻氧化应激、对抗干细胞衰老和巨噬细胞极化相关的免疫调节能力的协同作用,实现牙槽骨再生和PDL纤维的有序排列。本研究有望成为治疗糖尿病牙周炎的潜在策略。
牙周炎是一种由牙周病原体引起的慢性炎症性疾病,会对牙周组织造成不可逆转的损害,最终导致牙齿松动和脱落。糖尿病作为一组以慢性高血糖为特征的代谢综合征,与牙周炎有双向关系。糖尿病性牙周炎对牙周组织的损伤仍然是临床面临的一个棘手问题。糖尿病微环境中,牙周组织中AGEs和活性氧(ROS)的积累会产生大量的促炎因子,这些因子通过循环系统分散,进一步加重炎症反应,甚至损害整体健康。局部加重的炎症微环境使牙周膜干细胞等功能细胞更容易衰老从而失去功能,但破骨细胞的活性增加,这严重阻碍了牙周再生,限制了当前临床策略的有效性。因此,从加重炎症微环境到再生微环境的转化仍然是糖尿病牙周组织的一个挑战。
贻贝激发的聚多巴胺(PDA)能够通过清除活性氧和缓解氧化应激来减少糖尿病伤口微环境中的炎症。此外,PDA具有促进细胞粘附的细胞/组织亲和力。而二甲双胍(Metformin, Met)作为治疗2型糖尿病的典型口服降糖药,其骨调控性能也得到关注。但由于糖尿病牙周骨缺损部位存在典型的血管病变,使用口服给药Met很难达到有效浓度,需要开发可靠的生物材料来局部递送Met。

图1 用于糖尿病牙周炎的Met@TA-ZIF-PSG贴片合成及应用示意图。(a)PDA mSF的合成。(b)Met@TA-ZIF纳米颗粒的合成。(c)Met@TA-ZIF-PSG贴片交联网络中的非共价相互作用。(d)Met@TA-ZIF-PSG于植入部位发挥的生物学功能。(e)ROS聚积、M1/M2巨噬细胞比例失衡和过度炎性细胞因子分泌导致糖尿病牙周炎微环境中PDLSCs的衰老和胶原纤维的损伤。(f)Met@TA-ZIF-PSG贴片具有清除ROS、调控巨噬细胞极化、提高PDLSCs活力和促进牙周膜纤维重建的多重功能特性。
一、PDA-mSF和Met@TA-ZIF表现出更好的亲水性和稳定性,有利于Zn2+和Met的持续释放。Met@TA-ZIF-PSG复合贴片呈现多孔网状结构,PDA-mSF和结晶TA-ZIF包埋在基体中使其具有适度的力学性能,表现出较强的拉应力和强度以适应牙周治疗的需要(图2)。

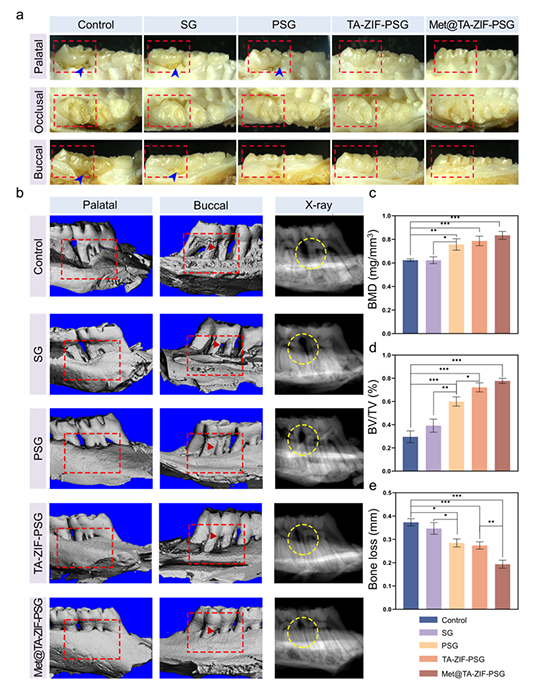
二、Met@TA-ZIF-PSG复合贴片在高糖炎症环境下可以促进人牙周膜干细胞(hPDLSCs)增殖和成骨向分化。该复合贴片能对抗高糖炎症环境导致的干细胞衰老损伤,同时其酚羟基对自由基的清除作用又能进一步减轻干细胞衰老、保证其功能活性(图3)。另外Met@TA-ZIF-PSG贴片还可以在高血糖炎症微环境下通过抑制M1巨噬细胞极化和激活M2巨噬细胞极化,以发挥巨噬细胞相关的免疫调节作用(图4)。


图4 Met@TA-ZIF-PSG贴片的抗衰老、清除ROS和免疫调节作用。(a)Met@TA-ZIF-PSG贴片抗衰老和ROS清除机制。(b)高糖炎症微环境下hPDLSCs衰老相关基因(P16、P21、P38和P53)的相对mRNA表达。(c)贴片清除细胞内ROS效能。(d-f)M1巨噬细胞相关基因白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的相对mRNA表达。(g-i)M2巨噬细胞相关基因精氨酸酶-1(Arg-1)、白细胞介素-4受体(IL-4R)和DECTIN的相对mRNA表达。



原文链接:Polydopamine-Mediated Immunomodulatory Patch for Diabetic Periodontal Tissue Regeneration Assisted by Metformin-ZIF System
Jinglei Gong, Chengxinyue Ye, Jinhui Ran, Xin Xiong, Xinyi Fang, Xueman Zhou, Yating Yi, Xiong Lu, Jun Wang, Chaoming Xie*, and Jin Liu*
ACS Nano 2023, XXXX, XXX, XXX-XXX
August 14, 2023
https://doi.org/10.1021/acsnano.3c02407
论文第一/通讯作者简介
第一作者:
巩靖蕾
四川大学华西口腔医学院博士研究生,以第一作者/共同第一作者在Adv. Funct. Mater.及BioMed Res. Int.杂志发表SCI收录论文2篇。
共同第一作者:
叶程心月,四川大学华西口腔医学院硕士研究生,以第一/共一作者发表SCI论文3篇,中文核心1篇。
通讯作者:
刘瑾,博士,四川大学华西医院国家老年疾病临床研究中心衰老及老年病机制研究室副教授。美国宾夕法尼亚大学和南加州大学访问学者/博士后。主要研究方向:1衰老和再生相关功能细胞亚群鉴定及命运调控;2骨/关节/皮肤损伤修复机制和干预策略应用转化研究;3胰腺再生。主持国家自然科学基金青年和面上项目3项,国家质检总局公益性项目子课题1项,四川省科技厅公益性研究计划2项,四川省科技厅应用基础研究1项。以第一/共一/通讯/共同通讯作者在Cell Reports, Journal of Dental Research, Cell Proliferation,Advanced Opitical Materials等国际期刊发表论文20余篇。获国家发明专利授权1项,申请美国和PCT国际专利一项。
谢超鸣, 西南交通大学医学院研究员, 四川省青年千人。2016年博士毕业于西南交通大学,2016-2018年在德国马克斯普朗克高分子研究所从事博士后研究。担任Nano-Micro Letters (IF=26.6), Smart Materials in Medicine杂志编委,中国生物材料学会生物材料表界面工程分会委员。主要研究方向为仿生生物材料表界面,以及多酚介导组织修复材料的研究。主持国家自然科学基金面上项目、国家自然科学基金青年项目、四川省科技厅项目、中国博士后科学基金特别资助、中国博士后科学基金面上等项目。相关成果发表在Nature Communications, Science Advances, Matter, JACS, Advanced Materials等国际期刊30余篇。获得授权专利12项。
