四川大学高会乐教授课题组 AFM:二甲双胍介导的空间特异性多响应无载体自组装纳米递药系统联合化疗重塑免疫抑制微环境
2024-02-21 来源:高分子科技
复杂的肿瘤免疫微环境调控需要药物的精准空间特异性释放,但大多数多药负载纳米粒会同时释放所有药物,使药物难以到达准确的作用位点。为了使药物的治疗效果最大化,设计一种能够实现空间特异性精确靶向的递药系统至关重要。无载体自组装纳米递药系统克服了传统载体递药系统载药能力低、载体代谢过程不明确等局限性。它们良好的生物相容性、生物可降解性、简单的构成与合成步骤在多药协同癌症治疗中具有广阔的发展前景。基于此,四川大学高会乐课题组在Advanced Functional Materials上发表相关研究,开发了一种多响应性无载体自组装纳米递药系统以实现不同药物的空间特异性释放,治疗乳腺癌及其转移。
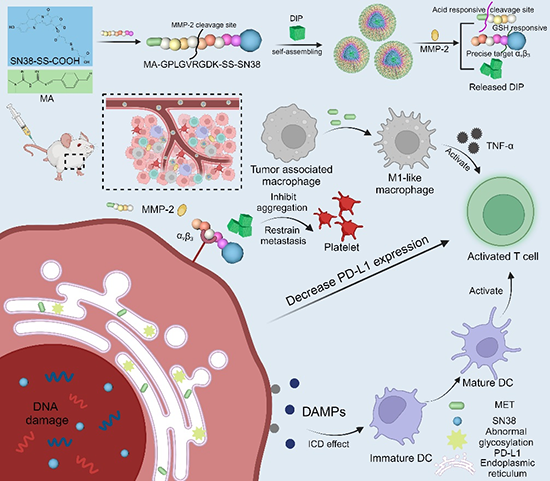
原文链接:https://doi.org/10.1002/adfm.202316145
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 中国科大龚兴龙教授课题组 Adv. Funct. Mater.:攀援植物启发的用于过渡复杂表面的多响应仿生驱动器 2024-10-17
- 瞿金平院士华科大团队 Small:基于弱离子交换的磁性微马达集群用于可控药物递送与化疗 2023-12-10
- 空军军医大学白永康/桂林理工李裕琪 CEJ:在多响应形状记忆驱动和自供电传感集成化材料方面取得新进展 2023-11-06
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 东华大学史向阳教授团队 AFM:微流控合成无载体全活性的金属酚纳米胶囊用于肿瘤的化疗-化学动力学治疗-免疫治疗 2024-12-02
- 清华大学化学系许华平教授课题组招聘博士后 2026-01-14
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
