慢性糖尿病伤口极易出现严重的皮肤坏死与细菌感染,活性氧(ROS)水平的升高以及持续的炎症反应会延长创面的愈合周期,长期的高血糖和缺氧环境使伤口极易受到细菌感染,形成生物膜并进一步阻碍愈合。针对糖尿病耐药菌感染创面的愈合难题,研发具备多种治疗功能的智能敷料,使其能够同时对抗感染、减轻氧化应激、缓解炎症并促进组织再生,至今仍是一项极具挑战性的任务。
为此,南开大学刘定斌教授、董建桐研究员与空军特色医学中心蔡宏主任合作,设计了一种智能响应的多功能水凝胶(Exo-Gel),自适应精准释放干细胞源性外泌体,结合自身抗菌和ROS清除的协同效应,加速耐甲氧西林金黄色葡萄球菌(MRSA)感染的糖尿病伤口愈合。
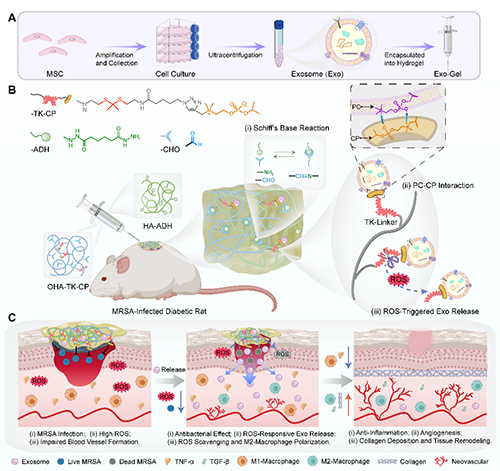
图1. 多功能水凝胶(Exo-Gel)通过局部精准递送干细胞外泌体、抑制细菌生长、调节免疫炎症反应及促进组织再生,加速糖尿病耐药菌感染创面的愈合机制示意图。
如图1所示,研究人员通过双腔注射器,将干细胞来源的外泌体(UC-MSC Exo)包裹在动态席夫碱水凝胶网络中,在糖尿病SD大鼠的MRSA感染的全层皮肤缺损伤口上原位形成Exo-Gel。 Exo-Gel利用了具有两性离子结构的磷酸胆碱(CP),实现双重功能:其一,通过与外泌体膜上的磷脂酰胆碱(PC)进行反向静电相互作用,实现对外泌体的固定;其二,通过正负电荷之间的静电相互作用,增强对阴离子细菌细胞膜的物理吸附,破坏其结构,从而发挥内在的抗菌作用。另外,创面环境中ROS诱导硫缩酮(TK)连接子发生裂解,触发UC-MSC外泌体的自适应释放;同时,高密度的TK基团可高效清除清除炎症伤口微环境中的ROS。最终,Gel和Exo的协同作用显著消除糖尿病伤口中的细菌感染,减轻氧化应激、调节M2巨噬细胞极化、促进血管生成,并通过胶原沉积、肌成纤维细胞收缩和迁移等过程,加速组织重塑和修复,从而促进MRSA感染的糖尿病伤口愈合。
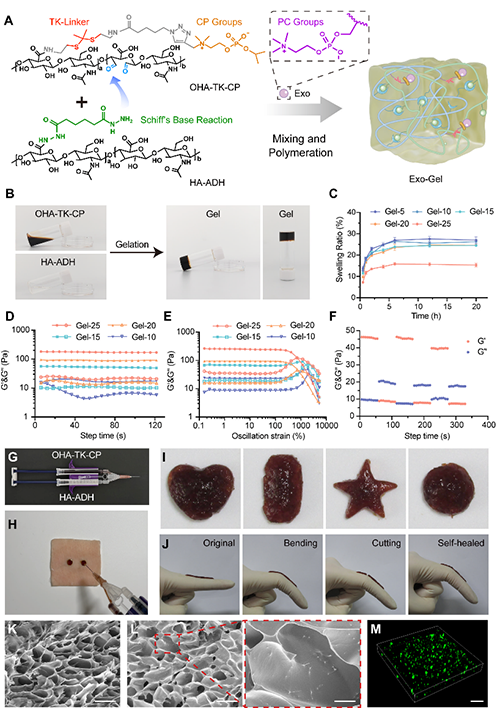
图2. Exo-Gel的制备过程及相关表征。
透明质酸(HA)在细胞外基质中发挥重要作用,其丰富的活性基团便于化学修饰。通过对HA进行氨基修饰得到透明质酸-己二酸二酰肼(HA-ADH),并对HA进行氧化和酰胺化反应制备硫缩酮和磷酸胆碱共修饰的氧化透明质酸(OHA-TK-CP)。随后,HA-ADH与OHA-TK-CP发生席夫碱反应,形成多孔水凝胶网络。再利用 CP-PC 相互作用负载脐带间充质干细胞(UC-MSC)来源的外泌体,最终得到 Exo-Gel。研究人员对Exo-Gel水凝胶的基本性质和形貌进行了表征(图2)。这种水凝胶具有出色的可注射性、自愈性、组织粘附性、止血性能和生物相容性,为伤口修复提供了良好的基础。
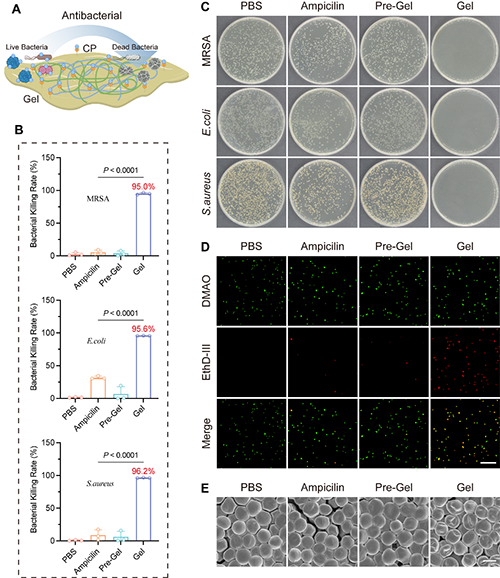
图3. Gel自身的抗菌性能。
Exo-Gel 的抗菌性能源于其自身网络结构中富含的 CP 基团。这些基团具有两性离子结构,能够与阴离子细菌细胞膜通过静电相互作用,破坏细胞膜结构,导致细菌死亡。图3结果显示,Gel 对MRSA、大肠杆菌和金黄色葡萄球菌的杀菌率分别高达 95.0%、95.6% 和 96.2%,远超氨苄青霉素对 MRSA 和金黄色葡萄球菌的抑制效果,Pre-Gel(未修饰TK和CP的HA水凝胶)和PBS对照组的抑菌作用则微乎其微。通过细菌平板培养、DMAO/EthD-III活死细菌染色法和SEM,证实了 Gel 强大的抗菌活性,可有效维持伤口的清洁环境。
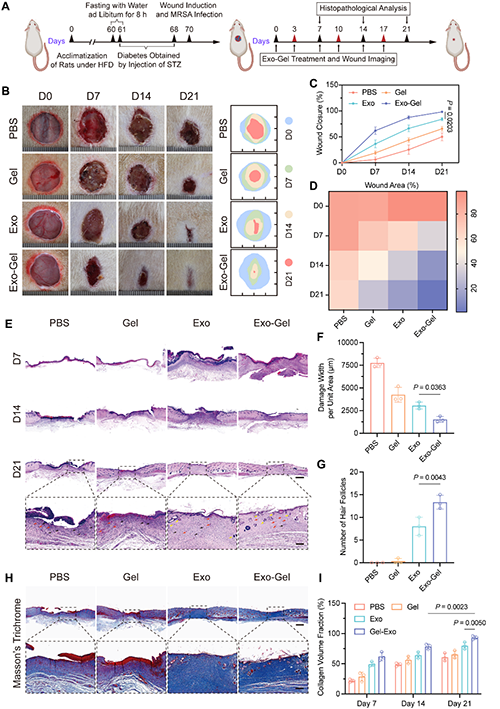
图4. 多功能水凝胶(Exo-Gel)在MRSA感染的糖尿病小鼠模型中显著促进创面愈合,验证其在耐药菌感染创伤修复中的治疗潜力。
研究人员借助MRSA感染全层伤口的糖尿病SD大鼠模型评估Exo-Gel的治疗效果(图4)。Exo-Gel展现出显著的抑菌活性,显著加速了伤口愈合进程,第21天的伤口闭合率高达 98%,远超Exo组和Gel组,而PBS组的愈合率仅50%。通过H&E染色和Masson三色染色对伤口组织进行分析,发现Exo-Gel组的真皮厚度近乎正常皮肤,炎症细胞浸润明显减少,伤口间隙变窄,胶原纤维排列有序且紧密,有力地促进了血管生成与组织再生。免疫荧光染色显示,该组Col-I和Col-III表达水平较高,Col- III/Col-I荧光强度比也更高,对减少瘢痕形成大有益处。进一步研究发现,Exo-Gel在体内能够有效清除ROS,伤口组织的ROS水平在第 21 天接近正常组织;并诱导创面处M1巨噬细胞向M2巨噬细胞极化,增强抗炎细胞因子的分泌,促进细胞增殖和血管生成,加速表皮和真皮的重建,实现了高效的伤口愈合与皮肤再生。值得一提的是,对主要器官的组织学染色以及血常规和生化参数检测均表明,Exo-Gel在伤口愈合过程中不会引发全身毒性,具备良好的生物安全性。
Exo-Gel多功能水凝胶通过创新的设计,将水凝胶的多种功能与干细胞外泌体的治疗作用相结合,在糖尿病伤口愈合的研究中取得了重要突破。Exo-Gel在体外和体内实验中都展现出了强大的抗菌、抗炎、促进细胞功能和伤口愈合的能力,为糖尿病伤口的治疗提供了一种简单、通用且经济高效的治疗新策略,无需外部组件或操作,具有高度的实用性与临床应用转化前景。
相关研究成果以“Self-Adaptive Release of Stem Cell-Derived Exosomes from a Multifunctional Hydrogel for Accelerating MRSA-Infected Diabetic Wound Repair”为题,于2025年4月30日发表在化学顶级期刊《Journal of the American Chemical Society》上。南开大学化学学院2022级博士生王翔为第一作者,南开大学化学学院刘定斌教授、董建桐研究员和空军特色医学中心皮肤科蔡宏主任为共同通讯作者。其他作者还包括南开大学化学学院康晶晶、洪晓琴和陈嘉铭、安徽医科大学陈许晶、中源协和干细胞基因工程有限公司研发中心杜为主任。此研究工作得到国家自然科学基金杰出青年科学基金和面上项目、天津市杰出青年科学基金和军委后勤开放重点项目的资助。
论文链接:
https://pubs.acs.org/doi/10.1021/jacs.5c02184
- 西南林大杜官本院士、杨龙研究员团队 Nano lett.:面向水下电子皮肤的温控响应纤维素基 Janus 智能水凝胶 2025-05-09
- 苏州大学王召教授团队 Nat. Commun.:二维MoS2压电催化剂加速聚合反应与水凝胶重塑 2025-02-20
- 西安交大陈鑫教授课题组 Small:具有生理响应性光热转换和纳米催化医学能力的智能水凝胶-可综合抑制细菌和炎症、治疗感染性伤口 2024-10-15
- 郑州大学刘军杰教授团队 Sci Adv:自主运动的口服药物递送系统用于结直肠癌的精准药物递送 2022-07-17
- 天津大学仰大勇教授课题组《Nat. Commun.》:聚合物纳米框架中DNA时空编程级联组装赋能核酸药物精准递送 2021-02-19
- 中科院纳米能源所李舟研究员与过程工程所魏炜研究员合作:纳米发电机控制的药物精准递送系统实现高效的肿瘤治疗 2019-02-18
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
