骨组织独特的生理环境为骨转移相关疾病的治疗带来了重大挑战,尤其现有的核酸递送系统,如脂质纳米颗粒(LNP)和聚乙烯亚胺(PEI),难以实现精准的骨靶向,严重限制了核酸药物在骨科领域的应用。
为应对上述挑战,同济大学杜建忠教授/朱云卿研究员和同济大学附属第十人民医院骨科贺石生教授在此前聚酰胺胺Pabol的研究基础上(Chem. Mater. 2024, 36, 5422-5435.),进一步引入骨亲和分子阿仑膦酸(ALN),成功设计了一种新型骨靶向核酸递送载体——聚[阿仑膦酸-co-(N,N′-双(丙烯酰)胱胺-co-4-氨基-1-丁醇)](ALN-Pabol)。该载体不仅能精准递送miRNA至骨转移瘤区域,还具备生物可还原、可降解、高包封效率、低毒性等优势,为骨组织疾病的核酸治疗提供了新策略。
具体研究思路如图1所示:ALN-Pabol通过静电作用与治疗性miRNA结合,形成稳定的ALN-Pabol/miRNA纳米复合物。该复合物在ALN的引导下精准定位骨组织,并在肿瘤高谷胱甘肽环境中响应性释放miRNA,激活抑癌基因GPER1以抑制肿瘤增殖并促进其凋亡。同时,ALN通过抑制破骨细胞活性缓解乳腺癌骨转移相关的溶骨性损伤,以此实现抗肿瘤+抗骨吸收双重疗效。

图1. 骨靶向ALN-Pabol/miRNA纳米复合物的制备以及其用于治疗乳腺癌骨转移瘤和相关溶骨性破坏的示意图。
为了避免纳米复合物由于粒径过小而被肾脏清除、提升其在肿瘤组织中的渗透性和滞留能力,纳米复合物的粒径范围需要控制在50~500 nm范围内,且确保粒径分布均匀。此外,纳米复合物表面的正电荷对核酸递送效率有重要影响:较高的正电荷有助于提高细胞摄取率和转染效率,但也可能导致更高的细胞毒性,因此需在效率与生物安全性之间取得平衡。为了实现对粒径与电荷的精准调控,团队优化了多个制备参数,包括聚合物与miRNA的质量比、缓冲液pH值、miRNA浓度、滴定速度及混合过程中的搅拌速度,最终成功制备出具备理想粒径、粒径分布及表面电荷特性的ALN-Pabol/miRNA纳米复合物(图2A, B)。通过透射电子显微镜(TEM)表征了纳米复合物的结构(图2C)。包封效率测定结果显示,Pabol、ALN0.1-Pabol和ALN0.2-Pabol的包封效率分别为91.7%、94.9%和96.8%,均超过90.0%,与当前主流商用递送系统如PEI 25K和LNP相当,表明制备的聚合物载体具有优异的核酸包载能力(图2D)。

图2. (A, B) 在最佳滴定条件下形成的各种聚合物/miRNA纳米复合物的流体力学直径 (Dh)、多分散性 (PD) 和zeta电位(ζ)。(C) 用1.0 wt %中性磷钨酸染色的ALN0.1-Pabol/miRNA复合物的TEM图像。(D) 不同纳米复合物的包封率。
阿仑膦酸(ALN)分子中的膦酸基团可与骨骼羟基磷灰石中的Ca2?离子发生稳定的双齿螯合作用,赋予其对骨组织的高度亲和性。因此,修饰了ALN的ALN-Pabol/miRNA纳米复合物能够与骨组织特异性结合,从而具备出色的骨靶向特性。在体外骨亲和性实验中,ALN接枝率为10.0%的ALN0.1-Pabol与羟基磷灰石粉末的结合率比Pabol高17.1%。进一步比较不同递送系统后发现,ALN-Pabol/miRNA纳米复合物与羟基磷灰石粉末的结合率分别比Pabol/miRNA、PEI/miRNA和Lipo/miRNA高17.6%、31.5%和33.6%(图3),充分证明其优异的骨组织亲和能力。此外,尾静脉注射48小时后的解剖荧光定量结果也印证了其骨靶向性能。与非靶向的Pabol/miRNA相比,ALN0.1-Pabol/miRNA纳米复合物在骨组织部位的荧光信号显著增强,表明该系统在体内同样具有高度骨组织富集能力(图4)。

图3. (A) 吸附在羟基磷灰石片上的ALN0.1-Pabol/miRNA纳米复合物的荧光显微镜图像。(B) 各纳米复合物与羟基磷灰石粉末的结合能力。(C) Pabol/miRNA和ALN0.1-Pabol/miRNA纳米复合物在HEPES缓冲液中4 ℃下储存30天的流体力学直径及多分散性随时间的变化。
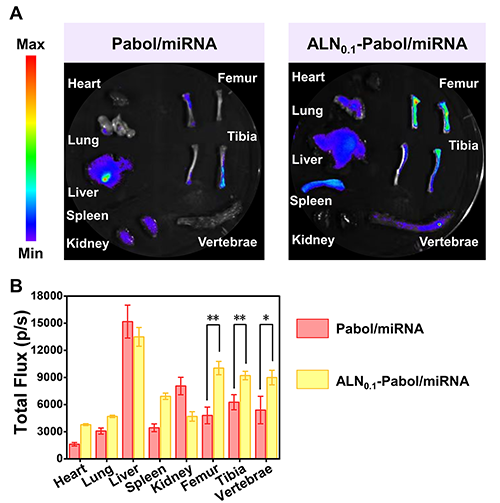
图4. Pabol/miRNA和ALN0.1-Pabol/miRNA纳米复合物的体内生物分布图像以及各组织中荧光分布强度的定量分析。
鉴于ALN0.1-Pabol/miRNA纳米复合物在体内具备良好的骨靶向性能,团队进一步构建了乳腺癌骨转移小鼠模型,评估了该递送系统在骨肿瘤治疗中的实际疗效。结果如图5所示,与其他组别相比,ALN0.1-Pabol/miRNA组裸鼠的骨肿瘤重量最小。免疫组化以及免疫荧光结果显示,该组裸鼠的肿瘤细胞中处于增殖状态的肿瘤细胞最少,处于凋亡状态的肿瘤细胞最多。这些结果表明该递送系统可有效激活抗肿瘤通路,抑制肿瘤细胞生长并诱导其凋亡。

图5. (A) 乳腺癌骨转移模型的建立以及治疗周期示意图。(B) 治疗完成后荷瘤腿的照片。(C) 不同治疗后从荷瘤腿上收集的肿瘤的平均重量。(D, E) 通过 Ki67 染色评估肿瘤细胞治疗后的增殖状态。(F) 通过TUNEL染色评估肿瘤细胞治疗后的凋亡状态。
团队还通过micro-CT成像技术进一步对ALN0.1-Pabol/miRNA在抑制骨溶解方面的效果进行了深入分析。如图6所示,PBS组和裸miRNA组小鼠在胫骨部位显示出了明显的骨折和骨溶解现象,而经ALN0.1-Pabol/miRNA纳米复合物治疗后,小鼠胫骨结构明显更为完整,骨溶解程度显著降低,骨组织形态与健康对照组几乎无异,疗效远优于其他处理组。进一步的骨骼结构参数定量分析显示,经ALN0.1-Pabol/miRNA纳米复合物治疗后,小鼠骨骼的各项指标(如骨体积、骨密度等)均恢复至接近正常水平,充分证明该递送系统在抑制骨转移瘤相关骨破坏方面具有显著疗效。

图6. (A) 不同治疗后荷瘤胫骨的micro-CT图像。(B) 不同治疗后小鼠荷瘤胫骨结构参数的定量分析。
综上所述,团队构建了一种基于可降解阳离子聚合物和阿仑膦酸(ALN)基团的新型核酸递送系统——ALN-Pabol,其在体外和体内均表现出优异的骨靶向能力,能够有效封装治疗性核酸并形成结构稳定的ALN-Pabol/miRNA纳米复合物,其在骨组织中实现了精准递送与局部释放,显著提升了对骨转移瘤的治疗效果。ALN的引入不仅显著增强了纳米复合物的骨亲和力,而且有效降低了系统性毒性。总之,ALN-Pabol为骨靶向基因治疗提供了一种新方法,具有广泛的适应潜力,有望拓展至骨关节炎、骨质疏松、骨肉瘤等多种骨相关疾病的治疗。
该研究成果近期以“Bone-Targeting Nucleic Acid Delivery Polymer Vector for Effective Therapy of Bone Metastasis”为题发表在《ACS Nano》上。同济大学高分子材料系硕士研究生李泽娟、同济大学附属第十人民医院博士研究生肖霄为论文的共同第一作者,贺石生教授、杜建忠教授和朱云卿研究员为共同通讯作者。该研究得到了国家自然科学基金等资助。
链接地址:https://doi.org/10.1021/acsnano.5c04743
- 上海交大傅德皓教授团队 ACS Nano: 仿生纳米囊泡逆转骨髓内皮细胞分泌表型治疗骨质疏松症 2022-07-13
- 吉林大学杜志阳团队 ACS Nano:食源性肽程式化共组装策略及其精准干预结肠炎的效用机制 2025-01-15
- 南华大学魏华/喻翠云团队ACS Macro Lett.封面:紫外光诱导环状聚合物载体的环状-线形拓扑结构变化用于胞内增强药物递送 2023-08-16
- 南开大学刘阳团队 Adv. Mater.: 通过新型聚合物载体控制抗菌肽的空间分布以安全有效地治疗癌症 2022-04-09
- 复旦大学占昌友教授团队:羟基PEG可规避人群预存抗PEG抗体 - 助力LNP高效递送 2024-10-30
- 北航常凌乾教授等《Adv. Funct. Mater.》:具有微纳电穿孔功能的微通道微针阵列用于实体肿瘤药物高效递送 2021-12-16
- 浙江大学高建青教授课题组在干细胞外泌体复合水凝胶局部埋植用于脊髓损伤治疗上取得新进展 2020-05-22
