近年来,抗菌肽(Antimicrobial peptide, AMPs)在抗癌治疗领域引起了广泛的关注,因为部分AMPs可在生物膜的诱导下呈现出生物活性高级构象,并通过快速且非受体介导的膜溶解机制杀死肿瘤细胞。更重要的是,这种抗肿瘤机制是一种新型作用模式,可绕过大多数耐药机制的发展。然而,由于AMPs的循环不稳定性、溶血毒性、选择性低和透膜能力差等缺陷,开发基于AMP的抗肿瘤疗法具有挑战性。最近,南开大学化学院刘阳团队提出了一种基于AMP的聚合物载体(表示为PAMPm-co-PPBEn/PCA),它可以精细地控制AMPs的空间分布,从而有效地调节AMPs的膜溶解毒性,以增强其抗癌功效,并将潜在的副作用降至最低。

图1. 聚合物载体PAMPm-co-PPBEn/PCA的示意图以及抗肿瘤机制
该载体通过在分子水平上整合多个响应结构,精细控制AMPs在不同生物微环境中的空间分布,从而有效调节其膜溶解毒性。聚合物载体由两种类型的聚合物组成,包括mPEG113-co-PLys120/CA(表示为 PCA)和携带AMPs的两亲性共聚物(表示为PAMPm-co-PPBEn)。PCA是一种pH响应性聚合物,在生理pH(pH 7.4)下显示负电荷,在酸性条件下(pH低于6.8)降解为阳离子聚合物(mPEG113-co-PLys120)。PAMPm-co-PPBEn由亲水性阳离子AMP接枝聚合物(PAMP)和疏水性活性氧(ROS)敏感的苯硼酸酯接枝聚合物(PPBE)组成。通过将这两种聚合物在水溶液中混合,形成了核-壳结构的纳米颗粒。以抗菌肽KLA作为模型AMP进行研究。
在血液循环和正常组织(pH 7.4)中,纳米颗粒保持稳定,并将KLA埋入内部(非活性模式,Inactive Mode),从而抑制KLA的膜溶解能力,表现为低蛋白吸附(图2a),低溶血毒性(图2b)以及对正常组织细胞无毒(图2c)。
当到达肿瘤组织时,由于PKLA和PLys之间的静电排斥作用,酸性微环境诱导PCA从外壳上分离,导致KLA暴露在纳米颗粒表面(穿透模式,Penetrating Mode)。有了阳离子表面,纳米颗粒可以被肿瘤细胞有效摄取(图2d)。
随后,肿瘤细胞内的高水平ROS触发PPBE部分的降解和纳米颗粒的解散,导致KLA刷状聚合物的释放(毒性模式,Toxic Mode)。由于刷状聚合物与线粒体膜的充分接触(图2f),这些KLA表现出增强的生物活性α-螺旋构象和对线粒体的膜溶解毒性(图2g)。体内外研究表明,这种方法显着提高了KLA的抗肿瘤效果并降低了其毒性(图2e和图2h)。
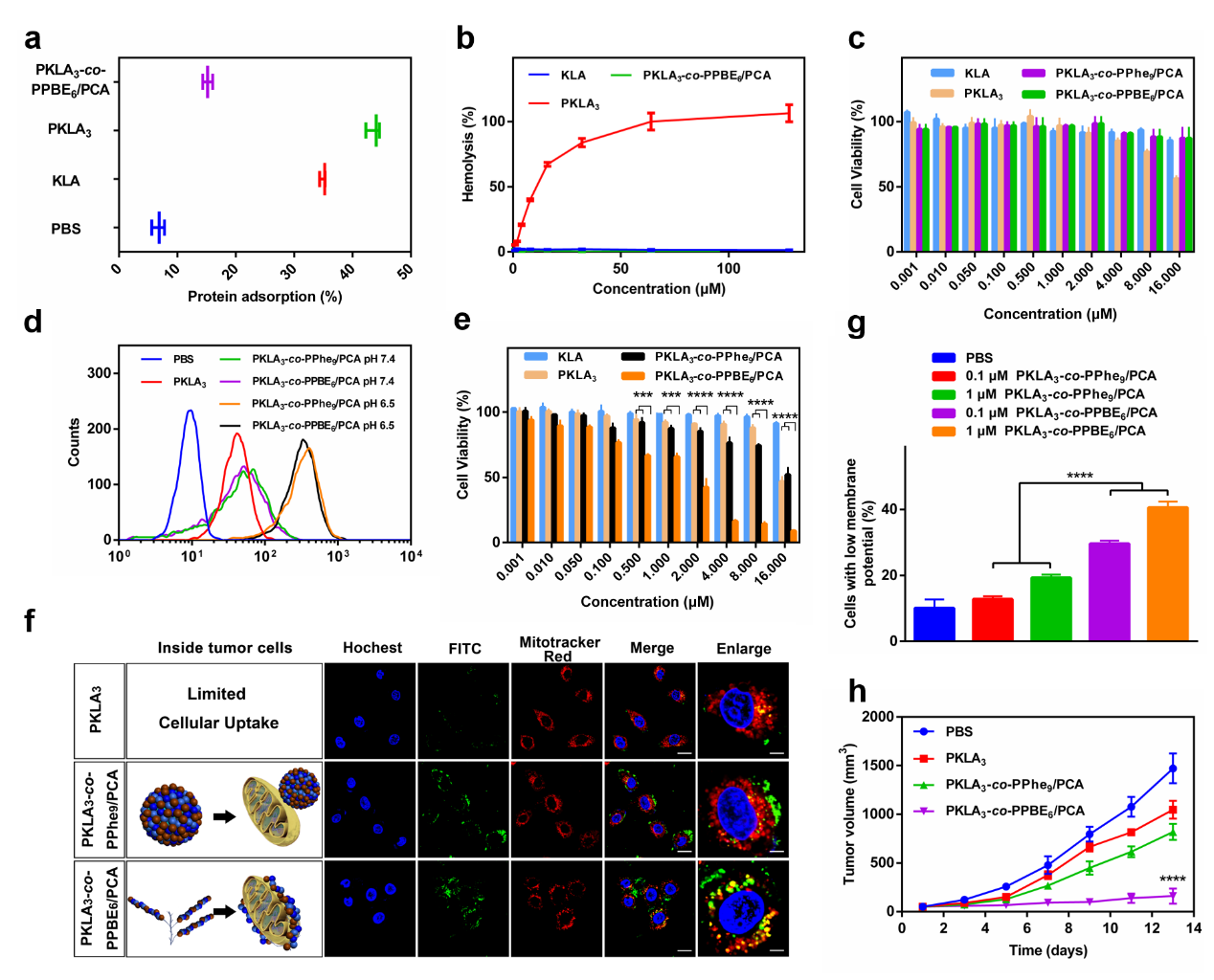
图2. PAMPm-co-PPBEn/PCA的安全性以及抗肿瘤评价
以上相关成果以“Spatial distribution control of antimicrobial peptides through a novel polymeric carrier for safe and efficient cancer treatment”为题发表于《Advanced Materials》上,该论文通讯作者为南开大学化学学院高分子化学与物理所刘阳研究员。该研究得到了国家自然科学基金等项目支持。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202201945
- 中科院长春应化所栾世方/殷敬华/石恒冲研究员团队 Angew VIP:模拟维生素U结构和高选择性的抗菌肽及其应对MRSA细菌感染 2023-12-26
- 华南理工大学贾永光、王琳 ACS AMI:发展非肽类面两亲构型的阳离子胆酸聚合物用于耐药菌感染治疗 2023-07-24
- 湖南大学白玉罡教授课题组 AHM:两亲性掩蔽策略用于提高抗菌肽模拟物的血液相容性 2022-05-18
- 同济大学杜建忠/朱云卿/贺石生团队 ACS Nano:骨靶向聚合物载体高效递送核酸治疗骨转移瘤 2025-05-07
- 吉林大学杜志阳团队 ACS Nano:食源性肽程式化共组装策略及其精准干预结肠炎的效用机制 2025-01-15
- 南华大学魏华/喻翠云团队ACS Macro Lett.封面:紫外光诱导环状聚合物载体的环状-线形拓扑结构变化用于胞内增强药物递送 2023-08-16
- 北京林业大学彭锋教授团队 AFM:通过精准核-壳结构调控构建红色及时间依赖变色磷光纤维素碳化聚合物点 2025-10-23
